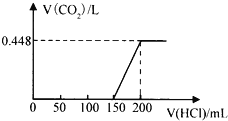
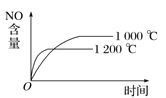
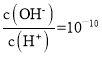��Ŀ����
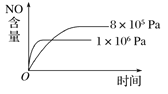
����Ŀ��һ�������£������Ϊ10 L���ܱ������У�1 mol X��1 mol Y���з�Ӧ��2X(g)��Y(g)![]() Z(g) ��H<0����Ӧ��60 s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����( )
Z(g) ��H<0����Ӧ��60 s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����( )
A. �����������䣬�����¶��淴Ӧ���ʼӿ죬����Ӧ���ʼ���
B. �����������䣬���������������20 L����Z��ƽ��Ũ�ȱ�Ϊԭ����![]()
C. �����������䣬�����������С��5 L��ƽ�������ƶ���ƽ�ⳣ������
D. ��YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.000 5 mol��L��1��s��1
���𰸡�D
��������
A�������¶ȣ������淴Ӧ���ʶ�����
B�������������䣬���������������20L��ѹǿ���ͣ�ƽ�����淴Ӧ�����ƶ���ƽ��ʱZ�����ʵ���С��0.3 mol�����![]() �жϣ�
�жϣ�
C����ѧƽ�ⳣ��ֻ���¶�Ӱ�죻
D�����ݷ���ʽ����μӷ�ӦY�����ʵ������ٸ���![]() ����
����![]() ��
��
A. �����¶ȣ������淴Ӧ���ʶ������淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ���A����ȷ��
B. �����������䣬���������������20 L��ѹǿ���ͣ�ƽ�����淴Ӧ�����ƶ���ƽ��ʱZ�����ʵ���С��0.3mol�������Ϊԭ����2����ƽ��ʱŨ��С��ԭƽ���![]() ��B�����
��B�����
C. ��ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��С�����ѹǿ����ƽ��������Ӧ�����ƶ���ƽ�ⳣ�����䣬C�����
D. ��Ӧ��60s�ﵽƽ��ʱ����0.3molZ�����ݷ���ʽ��֪,�μӷ�Ӧ��YΪ0.3mol������![]() ��D����ȷ��
��D����ȷ��
��ѡD��

 ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�