题目内容
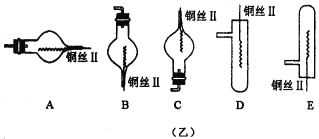
【题目】图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状。
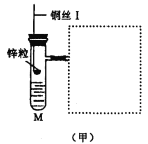
(1)在图甲中,试管M中的液体应选用_________________。
(2)在图示的虚线框中应连入的最合适的装置是___________(填代号)。
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有(写两点):__________________;________________ 。
(4)实验时,细铜丝“Ⅱ”的操作方法是_____________________________________________
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体应该是______________________,可用______________代替锌粒(写化学式), 发生反应的离子方程式为: _________________ 。
【答案】稀H2SO4或稀硫酸 B 易于控制H2的发生与停止 形成Cu—Zn原电池,加快反应速率 先在酒精灯上灼烧到红热状态,然后再迅速插入干燥管中 NaOH(KOH等强碱)溶液 Al 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
(1)制取氢气最为适宜的药品是锌粒和稀硫酸;
(2)根据氢气的密度小于空气的密度选择装置;
(3)根据铜制燃烧匙和锌在稀硫酸中 形成原电池加快反应速率,可以在试管M中上下移动,控制反应速率分析解答;
(4)实验时,细铜丝“Ⅱ”的操作方法是:先在酒精灯上灼烧到红热状态,然后再迅速插入干燥管中;
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,要制备氢气,又不能与铁丝反应,只有选用碱与铝反应。
(1)氢气的实验室制法中,最好的药品选择就是锌粒与稀硫酸,因为反应速率适中易于控制,而且不会影响氢气的纯度;
(2)因为氢气的密度比空气小,所以选B装置才能收集氢气并且完成氢气与氧化铜的反应;
(3)根据题目信息燃烧匙可以在试管M中上下移动,当燃烧匙脱离稀硫酸的液面时,反应物分离,反应停止。需要反应进行时可再将燃烧匙插入液面以下,由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止;
(4)实验时,细铜丝“Ⅱ”的操作方法是:先在酒精灯上灼烧到红热状态,然后再迅速插入干燥管中;
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,要制备氢气,又不能与铁丝反应,只有选用碱与铝反应,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。