题目内容
15.下列叙述正确的是 ( )| A. | H2、D2、T2三者互为同素异形体 | |
| B. | NH4Cl的电子式为: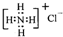 | |
| C. | 放射性同位素${\;}_{67}^{166}$Ho的原子核内的中子数与核外电子数之差是32 | |
| D. | 聚丙烯的结构简式为: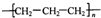 |
分析 A.同素异形体是同种元素形成的不同单质;
B.NH4Cl的电子式中氯离子没有标出最外层电子;
C.根据原子符号的含义以及中子数=质量数-质子数,核外电子数=核内质子数;
D.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,注意原子之间连接.
解答 解:A.H2、D2、T2是由氢的同位素原子构成的氢分子,都是由同种元素组成的结构相同的单质,属于同种物质,不是同素异形体,故A错误;
B.NH4Cl为离子化合物,阴阳离子需要标出所带电荷,铵根离子和氯离子还应该标出最外层电子,氯化铵正确的电子式为: ,故B错误;
,故B错误;
C.同位素67166Ho的质子数位67,核外电子数为67,质量数位166,中子数=166-67=99,中子数与核外电子数之差为99-67=32,故C正确;
D.聚丙烯是由丙烯不饱和的碳原子相互加成得到的,其结构简式为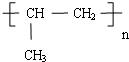 ,故D错误.
,故D错误.
故选C.
点评 本题考查了同素异形体、电子式、结构简式的判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
17.下列对化学反应的认识错误的是( )
| A. | 会引起化学键的变化 | B. | 元素的种类可能发生变化 | ||
| C. | 会产生新的物质 | D. | 必然伴随着能量的变化 |
18.下列有机物完全燃烧,生成二氧化碳和水的物质的量不可能相等的是( )
| A. | 醛类 | B. | 烷烃 | C. | 烯烃 | D. | 酯类 |
3.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)O<Al<Na.
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)H2SiO3<H2CO3<HNO3.
(2)写出由以上①④⑤元素构成的化合物的电子式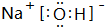 ;该化合物含有的化学键类型有离子键、共价键.
;该化合物含有的化学键类型有离子键、共价键.
(3)⑥的最高价氧化物分别与强酸、强碱反应的离子方程式为Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-=2AlO2-+H2O.
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)H2SiO3<H2CO3<HNO3.
(2)写出由以上①④⑤元素构成的化合物的电子式
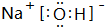 ;该化合物含有的化学键类型有离子键、共价键.
;该化合物含有的化学键类型有离子键、共价键.(3)⑥的最高价氧化物分别与强酸、强碱反应的离子方程式为Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-=2AlO2-+H2O.
10.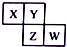 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
20.已知蓝铜矿的主要成分为2CuCO3•Cu(OH)2,用焦炭与蓝铜矿加热可用于工业炼铜,同时产生一种常见的能产生温室效应的气体和一种常见液体.下列叙述不正确的是( )
| A. | 1mol 2CuCO3•Cu(OH)2完全反应转移电子的数目为6NA | |
| B. | 该反应在理论上用1mol焦炭可以还原得到2mol铜 | |
| C. | 该反应的氧化剂与还原剂的物质的量之比为4:3 | |
| D. | 工业炼铜还可以采用以下方法:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 |
7.下列应用不涉及氧化还原反应的是( )
| A. | Na2O2用作呼吸面具的供氧剂 | |
| B. | FeCl3溶液用于铜质印刷线路板制作 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 84消毒液用于环境消毒 |
4.对于放热反应:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法一定正确的是( )
| A. | 该反应涉及到了共价键和离子键的断裂和形成 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1molH-H键和1mol Cl-Cl键,所吸收的总能量,小于形成1molH-Cl键,所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
5.在给定条件下,下列画横线的物质在化学反应中能被完全消耗的是( )
| A. | 常温下将64g铜片投入过量浓硫酸中 | |
| B. | 向5.5gMnO2粉末中加入20mL2mol•L-1双氧水 | |
| C. | 向10mL3mol•L-1的盐酸中加入5.6g铁 | |
| D. | 向含有Ba(OH)2和NaOH各0.1mol的混合溶液中通入标况下11.2CO2 |