题目内容
5.在给定条件下,下列画横线的物质在化学反应中能被完全消耗的是( )| A. | 常温下将64g铜片投入过量浓硫酸中 | |
| B. | 向5.5gMnO2粉末中加入20mL2mol•L-1双氧水 | |
| C. | 向10mL3mol•L-1的盐酸中加入5.6g铁 | |
| D. | 向含有Ba(OH)2和NaOH各0.1mol的混合溶液中通入标况下11.2CO2 |
分析 A.铜浓硫酸在加热条件下才能发生反应;
B.二氧化锰在双氧水分解的反应中只起催化剂作用;
C.铁与盐酸反应生成氯化亚铁,依据氯化氢的物质的量与铁的物质的量判断解答;
D.利用n=$\frac{V}{22.4}$计算二氧化碳的气体,再反应的先后顺序及CO2+2OH-═CO32-+H20及来分析.
解答 解:A.常温下铜与浓硫酸不反应,故A错误;
B.二氧化锰在双氧水分解的反应中只起催化剂作用,反应后二氧化锰的质量不变化,故B错误;
C.盐酸含氯化氢的物质的量为0.1L×3mol/L=0.3mol,铁的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,依据Fe~2HCl 可知铁能够完全反应,故C正确;
D.二氧化碳的体积为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有Ba(OH)2和NaOH各0.1mol的混合溶液溶共含有氢氧根离子0.3mol,依据CO2+2OH-═CO32-+H20,二氧化碳不能完全被吸收,故D错误;
故选:C.
点评 本题考查物质的性质及相关的化学反应,明确发生的化学反应,依据方程式判断反应物的消耗是解题关键,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
15.下列叙述正确的是 ( )
| A. | H2、D2、T2三者互为同素异形体 | |
| B. | NH4Cl的电子式为: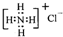 | |
| C. | 放射性同位素${\;}_{67}^{166}$Ho的原子核内的中子数与核外电子数之差是32 | |
| D. | 聚丙烯的结构简式为: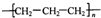 |
13.下列操作使溶液物质的量浓度偏高的是( )
| A. | 没有将洗涤液转移到容量瓶中 | B. | 容量瓶洗净后未经干燥处理 | ||
| C. | 转移过程中有少量的溶液溅出 | D. | 定容时俯视容量瓶刻度线 |
20.下列各组离子在水溶液中一定能大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | Na+、Fe3+、NO3-、SCN- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | Fe2+、H+、NO3-、Cl- |
10.与OH-具有相同质子数的微粒是( )
| A. | Na+ | B. | NH4+ | C. | CH4 | D. | F- |
14.实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A. | Al3+、K+、SO42-、Cl-、AlO2- | B. | Fe2+、H+、Br-、NO3-、Cl- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Al3+、Na+、Cl-、SO42-、NO3- |
 铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:
铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题: