题目内容
4.对于放热反应:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法一定正确的是( )| A. | 该反应涉及到了共价键和离子键的断裂和形成 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1molH-H键和1mol Cl-Cl键,所吸收的总能量,小于形成1molH-Cl键,所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
分析 A.根据H2、Cl2、HCl都是由非金属元素之间形成,而非金属元素之间易形成共价键(铵盐除外)判断;
B.放热反应反应物所具有的总能量高于产物所具有的总能量;
C.放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D.放热反应中化学能转变为热能、光能等.
解答 解:A.因为H2、Cl2、HCl都是由非金属元素之间形成,则该反应只涉及到了共价键的断裂与形成,没有离子键的断裂与形成,故A错误;
B.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,所以反应物所具有的总能量高于产物所具有的总能量,故B正确;
C.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,断开1mol H-H键和1mol Cl-Cl键,所吸收的总能量,小于形成2mol H-Cl键,所放出的能量,故C错误;
D.放热反应中化学能转变为热能、光能等,故D错误.
故选B.
点评 本题主要考查了化学反应的本质以及能量变化的宏观和微观原因,难度不大,注意基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.已知短周期主族元素W,X,Y,Z的原子序数依次增大,W,X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | Y,Z形成的分子空间构型可能是正四面体 | |
| B. | W,Y,Z的电负性大小顺序一定是Z>Y>W | |
| C. | WY2分子中δ键与π键的数目之比是2:1 | |
| D. | W,X,Y,Z的原子半径大小顺序可能是W>X>Y>Z |
15.下列叙述正确的是 ( )
| A. | H2、D2、T2三者互为同素异形体 | |
| B. | NH4Cl的电子式为: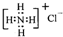 | |
| C. | 放射性同位素${\;}_{67}^{166}$Ho的原子核内的中子数与核外电子数之差是32 | |
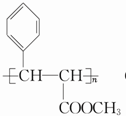
| D. | 聚丙烯的结构简式为: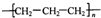 |
12.下列关于化学反应与能量的说法正确的是( )
| A. | 需要加热才能发生的化学反应不一定是吸热反应 | |
| B. | 化学键断裂放出能量 | |
| C. | 燃料电池的负极发生还原反应 | |
| D. | 氢氧化钡晶体与氯化铵的反应是放热反应 |
19.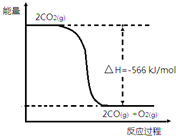 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
( )
 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
( )
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
13.下列操作使溶液物质的量浓度偏高的是( )
| A. | 没有将洗涤液转移到容量瓶中 | B. | 容量瓶洗净后未经干燥处理 | ||
| C. | 转移过程中有少量的溶液溅出 | D. | 定容时俯视容量瓶刻度线 |
14.实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A. | Al3+、K+、SO42-、Cl-、AlO2- | B. | Fe2+、H+、Br-、NO3-、Cl- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Al3+、Na+、Cl-、SO42-、NO3- |
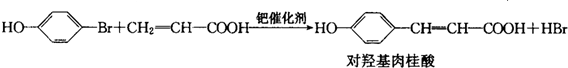

 .
.
 .
. .
. 和
和 .
. 铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:
铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题: