题目内容
2.在冷暗条件下就能跟H2发生剧烈反应而爆炸的物质是( )| A. | N2 | B. | F2 | C. | O2 | D. | C12 |
分析 元素的非金属性越强,其单质的氧化性越强,与氢气反应越容易、越剧烈,据此分析解答.
解答 解:元素的非金属性越强,其单质的氧化性越强,与氢气反应越容易、越剧烈,
A.氮气和氢气在高温高压催化剂条件下发生化合反应生成氨气,故A不选;
B.这几种物质中非金属性最强的是F元素,则氟气的氧化性最强,和氢气在冷暗处就能发生剧烈反应而发生爆炸,故B选;
C.氧气和氢气在点燃条件下反应生成水,故C不选;
D.氯气和氢气在点燃或光照条件下反应生成氯化氢,故D不选;
故选B.
点评 本题考查气体之间的反应,侧重考查学生分析判断能力,明确物质性质是解本题关键,知道常见气体和氢气反应条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法中正确的是( )
| A. | 能发生银镜反应的物质不一定是醛 | |
| B. | 酯在碱性条件下的水解生成相应的羧酸和醇 | |
| C. | 参与酯化反应的物质一定有两种 | |
| D. | 苯酚中羟基对苯环的影响是使苯环上氢原子都变的很活泼 |
13.同周期的X、Y、Z三种元素的最高价氧化物对应水化物分别是:H3XO4、H2YO4、HZO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
14.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L盐酸与锌反应时,用锌粉代替锌粒,生成氢气的速率不变 | |
| B. | 对于反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,反应速率减慢 | |
| D. | 用铁片和稀硫酸反应制取氢气时,将稀硫酸改为浓硫酸可以加快生成氢气的速率 |
11.锌-溴蓄电池的充、放电的电池总反应为Zn+Br2$?_{充电}^{放电}$Zn2++2Br-,下列各反应:①Zn-2e-=Zn2+;②Br2+2e-=2Br-;③2Br--2e-=Br2;④Zn2++2e-=Zn,其中充电的阳极和放电的负极的反应分别是( )
| A. | ①② | B. | ③② | C. | ④② | D. | ③① |
12.下列说法不正确的是( )
| A. | 铝原子核外有13种不同运动状态的电子 | |
| B. | 前四周期元素中,基态原子中成对电子数与其所在周期数相同的元素有6种 | |
| C. | 第一电离能介于B、N之间的第二周期元素有3种 | |
| D. | HF的水溶液中存在4种氢键 |
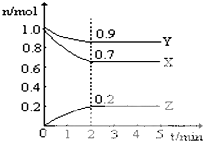 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: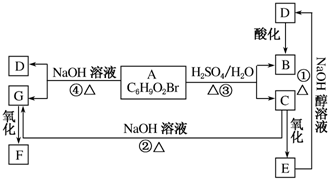 有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G相互关系如图所示.已知F分子中含有两个相同的官能团,5.2gF能与100mL1mol•L-1的NaOH溶液恰好完全中和.D的分子式为C3H3O2Na,E的分子中含有羧基.