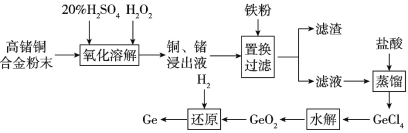
��Ŀ����
����Ŀ���������س��õ�NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2��HI�ܷ������·�Ӧ��______NaNO2 +_______HI ��_________NO��+_____ I2 + _________NaI +_____
��1���뽫�����ﲹ����������ƽ�����õ����ŷ��������ת�Ƶķ������Ŀ��___________
��2��������Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_________������״��������3.36L NO����Ӧ��ת�Ƶ��ӵ���Ŀ��______________��
��3������������Ӧ��������ֽ�������г��������ʽ���ʵ�飬�Լ���NaNO2��NaCl����ѡ�õ������У���ˮ �ڵ��۵⻯����ֽ �۵��� �ܰ���ʳ�ף�����ʵ��ѡ�����ʺ��ʵ���______������ĸ��ţ���
A���٢� �� B���٢� �� C���٢ڢ� D���ڢܢ�
��4��ij������Һ�У�����2%��5%��NaNO2��ֱ���ŷŻ������Ⱦ������NH4Cl��ʹNaNO2ת��Ϊ�����������Ⱦ��N2����Ӧ�Ļ�ѧ����ʽΪ_______________��
��5��������ͨ��NaNO2��Һ�У�����NaNO3��HCl��д����Ӧ�����ӷ���ʽ��______��
��6���������οɽ�������Я������Ѫ�쵰��ת����������Ѫ�쵰�ף�ʧȥЯ��������������֯ȱ�������ж������������������ж�����Ч�ⶾ��������˵���в���ȷ����_______��
A�����ж�������Я������Ѫ�쵰�ױ����� B���ж�ʱ�������η���������Ӧ
C��ҩƷ����Ӧ���л�ԭ�� D���ⶾʱ������Ѫ�쵰�ױ���ԭ
���𰸡�2 4 2 1 2 2 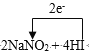 = 2NO�� + I2 + 2NaI + 2H2O 1:1 0.15N A C NaNO2 + NH4Cl = NaCl + N2��+ 2 H2O NO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+ B
= 2NO�� + I2 + 2NaI + 2H2O 1:1 0.15N A C NaNO2 + NH4Cl = NaCl + N2��+ 2 H2O NO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+ B
��������
(1) ��������ԭ��Ӧ�У����ϼ�����ֵ=���ϼ۽���ֵ=ת�Ƶ����������õ����غ�����ƽ����ʽ����������ʧ���ӵ�����ָ��õ������ʣ�������ת�Ƶĵ�������
(2)�����ݻ��ϼ������ж������������ϼ۽���Ԫ�����ڵķ�Ӧ���������������ݻ�ѧ����ʽ��ϵ���ת����������㣻
(3) �����ݷ�Ӧʱ�г��������塢��ɫ�仯����������ѡ���Լ���
(4)(5)������������ԭ��Ӧ�Ĺ�����д��
(6)���������ƽ�������ɽ�ѪҺ�еĵ���Ѫ�쵰�������ɸ���Ѫ�쵰�ף����������ξ��������ԣ�FeԪ�صĻ��ϼ����ߣ�ʹ�����ж������������������ж�����Ч�ⶾ�������������л�ԭ�ԣ��������ӷ�Ӧ���ɽⶾ���Դ������
(1)���ڷ�Ӧ�У�NԪ�صĻ��ϼ۴�+3�۽��͵���+2�ۣ��õ���1mol���ӣ�IԪ�صĻ��ϼ۴�- 1�����ߵ���0�ۣ���ʧȥ����2mol�����ݵ����غ㣬������Ԫ�ص�����ǰ�߶�����ϵ��2���ⵥ��ϵ����1����
��ԭ���غ㣬NaI ǰ�ߵ�ϵ��Ϊ2��HI ǰ�ߵ�ϵ����4��ˮ��ǰ����ϵ��2���ʴ�Ϊ2; 4; 2;1; 2; 2.�� = 2NO�� + I2 + 2NaI + 2H2O��
= 2NO�� + I2 + 2NaI + 2H2O��
(2)��2NaNO2 + 4HI=2NO+ I2+ 2NaI+ 2H2O����Ԫ�صĻ��ϼ۽��ͣ�����2molNaNO2����������4molHI��
�뷴Ӧ����2molHIΪ��ԭ�����÷�Ӧת�Ƶ�����2mol��3.36L NO�����ʵ�Ϊ0.15mol����������0.15molNO���ɣ���Ӧ��ת�Ƶ��ӵ���Ŀ��0.15moL����0.15N A��
�ʴ�Ϊ��1:1��0.15N A��
(3)��ˮ���۵��ۡ��ܰ���NaNO2������Ӧ����������������KI��NaNO2��Ӧ����I2���������������²��ܷ�Ӧ��ʳ���������������ӣ��⻯����ʳ�ױ��������ܼ�ˮ�е���������ӣ��������Ƶ������������������ӣ�������Ӧ���ɵⵥ�ʣ�I2ʹʪ��ĵ��۵⻯����ֽ�������ʢ٢ڢ���ȷ��
�ʴ�Ϊ��C��
(4)�����������е��õ�3������ָ�����еĵ����Ȼ���е�ʧȥ3����ָ�����еĵ�������ʽΪ��NaNO2 + NH4Cl = NaCl + N2��+ 2H2O��
�ʴ�Ϊ��NaNO2 + NH4Cl = NaCl + N2��+ 2H2O��
(5)��������ͨ��NaNO2��Һ�У�����NaNO3��HCl��������C1Ԫ�ػ��ϼ۽�������������NaNO2��NԪ�ػ��ϼ���������ԭ�����ʷ�Ӧ�����ӷ���ʽΪ��NO2-+ Cl2+ H2O = NO3-+ 2Cl-+2H+��
(6)A�����ж�������Ѫ�쵰����FeԪ�صĻ��ϼ����ߣ�����������A��ȷ��
B���ж�ʱ���������е�NԪ�ػ��ϼ۽��ͣ���������������ԭ��Ӧ����B����
C��ҩƷ�����ڽⶾ�����У������仹ԭ�ԣ�����ԭ������C��ȷ��
D���ⶾʱ����Ѫ�쵰�õ�����������������������ԭ�����Ա���ԭΪ����Ѫ�쵰�ף���D��ȷ��
��ѡB��

����Ŀ�����ȫ����ڵ������쳣�����������ٴγ�Ϊ���㡣SO2��NOx��CO2�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����
(1)��֪��H2O(g)=H2O(l)�� ��H1=-Q1 kJ/mol
C2H5OH(g)=C2H5OH(l)�� ��H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2 (g)+3H2O(g)�� ��H3=-Q3 kJ/mol
��23gҺ̬�ƾ���ȫȼ�ղ��ָ������·ų�������Ϊ________________kJ��
(2)�±�Ϊ��Ӧ2SO2(g)��O2 (g)![]() 2SO3(g)����Ӧ�¶���ƽ�ⳣ������ֵ���ɴ˵ó��÷�Ӧ����H__________0������>����=������<������
2SO3(g)����Ӧ�¶���ƽ�ⳣ������ֵ���ɴ˵ó��÷�Ӧ����H__________0������>����=������<������
T/�� | 700 | 800 | 830 | 1 000 | 1 200 |
K | 2.6 | 1.9 | 1.0 | 0.7 | 0.6 |
(3)����֪����2L�ܱ������У�17�桢1.01��105Pa�����£�2NO2(g)![]() N2O4(g) ��H<0��ƽ�ⳣ��K=13.3�����˷�Ӧ�ﵽƽ��ʱ����n(NO2)=0.060mol����c(N2O4)=_______(������λ��Ч����)��
N2O4(g) ��H<0��ƽ�ⳣ��K=13.3�����˷�Ӧ�ﵽƽ��ʱ����n(NO2)=0.060mol����c(N2O4)=_______(������λ��Ч����)��
�����ı�������ϵ��ij���������ﵽ�µ�ƽ���û��������c(NO2)=0.040mol/L��c(N2O4)=0.0070mol/L����ı��������______________��
����Ŀ����֪����1mol��ѧ�����յ��������γ�1mol��ѧ���ͷŵ�������Ϊ���ܣ��������ʵļ������±���ʾ��
��ѧ�� | C-H | C=O | N-H | C-N | H-O |
���ܣ�kJ/mol�� | a | b | c | d | e |
��ȩ�Ʊ�������Ʒ�ķ�Ӧ���£�6![]() (g) + 4NH3(g) ��
(g) + 4NH3(g) ��  + 6H2O(l)
+ 6H2O(l)
�÷�Ӧ���SHΪ �� ��
A. 6��a+b+c-d-e��kJ/molB. 6��d+e-a-b-c��kJ/mol
C. 6��b+2c-2d-2e��kJ/molD. 6��2d+2a+2e-b-3c��kJ/mol
����Ŀ��I. ��ѧ���о���һ������Ȼ��Ϊȼ�ϵ���ȼ��ǰ����ϵͳ�������������ͼ��ʾ����(����������δ���)��
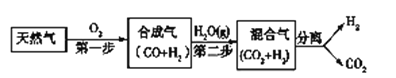
��1����ҵ�Ͽ���H2��CO2�Ʊ��״����䷴ӦΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ij�¶��£���1 mol CO2��3 mol H2������������2 L�ܱ������У�����������Ӧ����ò�ͬʱ�̷�Ӧǰ���ѹǿ��ϵ���£�
CH3OH(g)+H2O(g)��ij�¶��£���1 mol CO2��3 mol H2������������2 L�ܱ������У�����������Ӧ����ò�ͬʱ�̷�Ӧǰ���ѹǿ��ϵ���£�
ʱ��/h | 1 | 2 | 3 | 4 | 5 | 6 |
P��/Pǰ | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
��H2 ��ʾǰ2 hƽ����Ӧ����v(H2) ��__________ mol����L��h)-1��
��2����300 ����8 MPa�£���������̼�����������ʵ���֮��Ϊ1��3ͨ��һ�ܱ������з���(1)�з�Ӧ���ﵽƽ��ʱ����ö�����̼��ƽ��ת����Ϊ50%����÷�Ӧ�����µ�ƽ�ⳣ��Kp�� ________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
��3��CO2��������ɺϳɵ�̼ϩ����2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H����0.1 MPaʱ����n(CO2)��n(H2)��1��3Ͷ�ϣ���ͼ��ʾΪ��ͬ�¶�(T)�£�ƽ��ʱ������̬���ʵ����ʵ���(n)��ϵ��
C2H4(g)+4H2O(g) ��H����0.1 MPaʱ����n(CO2)��n(H2)��1��3Ͷ�ϣ���ͼ��ʾΪ��ͬ�¶�(T)�£�ƽ��ʱ������̬���ʵ����ʵ���(n)��ϵ��
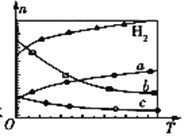
�ٸ÷�Ӧ����H ______ 0 (������������������������)��
������c��ʾ������Ϊ ____________________��
II. �������ֳ��������ᣬ����(H3AsO4)��������(H3AsO3)��ijС����̽�����淴ӦAsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O���������ͼI��ʾװ�á�ʵ�����������:��ͼIװ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼIװ������ձ�����μ���һ����2mol/L�����ᣬ�����ֲ���������ʵ���е�����ʱ�Ĺ�ϵ��ͼII��ʾ��
AsO43- + 2I- + H2O���������ͼI��ʾװ�á�ʵ�����������:��ͼIװ�ü����Լ�������װ�ã�������C2����C1����������Ϊ��ʱ����ͼIװ������ձ�����μ���һ����2mol/L�����ᣬ�����ֲ���������ʵ���е�����ʱ�Ĺ�ϵ��ͼII��ʾ��
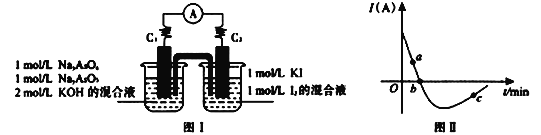
��1��ͼII��AsO43-���淴Ӧ����:a____b( ����>������<������=�� )��
��2��д��ͼII��c���ӦͼIװ�õ�������Ӧʽ__________________________��
��3�����жϸ÷�Ӧ�ﵽƽ��״̬����________��
a.2v(I-)��=v(AsO33-)��b.��Һ��pH���ٱ仯
c.������ʾ����Ϊ�� d.��Һ��ɫ���ٱ仯
����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2���䷴ӦΪ��2NO��2CO![]() 2CO2��N2�����賣�����ں��ݵ��ܱ������з���������Ӧ���Խ���������⣺
2CO2��N2�����賣�����ں��ݵ��ܱ������з���������Ӧ���Խ���������⣺
��1�����������¸÷�Ӧ�ܹ��Է����У���Ӧ����H_____0����д��������������������������
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____________��
A����������ѹǿ���ֲ���
B��N2��Ũ�Ȳ��ٸı�
C������CO�����ʵ���������CO2�����ʵ���֮��Ϊ1��1
D��NO��CO��CO2��N2�����ʵ���֮��Ϊ2��2��2��1
��3����Ҫ�ӿ췴Ӧ������Ҫ���NOת���ʣ����д�ʩ���е���____________��
��A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
��C�����ͷ�Ӧ��ϵ���¶� D����С���������
��4��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ�ij��ѧ����ij�¶��������崫������ò�ͬʱ���NO��COŨ����������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) ( molL��1) | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
c(CO) ( molL��1) | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | X | 2.70��10��3 |
�ӱ������ݷ�����֪��
��X��____________mol��L��1��
��ǰ2s�ڵ�ƽ����Ӧ����v(N2)��________________________mol��L��1��s��1��
�۸��¶��·�Ӧ��ƽ�ⳣ��K��________________________��