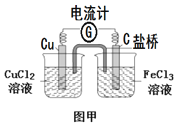
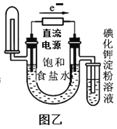
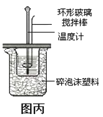
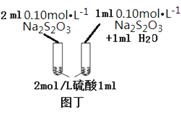
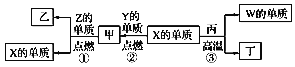
题目内容
【题目】对甲基苯胺可用对硝基甲苯作原料在一定条件制得。 主要反应及装置如下:
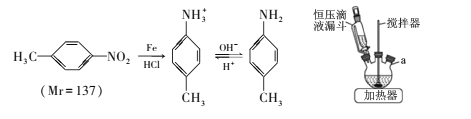
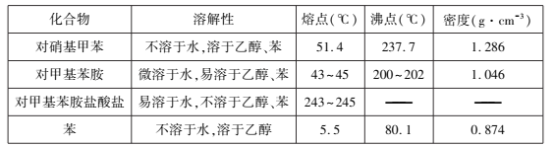
主要反应物和产物的物理性质见下表:
实验步骤如下:
①向三颈烧瓶中加入50mL稀盐酸、10.7mL(13.7g)对硝基甲苯和适量铁粉,维持瓶内温度在80℃左右,同时搅拌回流、使其充分反应;
②调节pH=7~8,再逐滴加入30mL苯充分混合;
③抽滤得到固体,将滤液静置、分液得液体M;
④向M中滴加盐酸,振荡、静置、分液,向下层液体中加入NaOH溶液,充分振荡、静置;
⑤抽滤得固体,将其洗涤、干燥得6.1g产品。
回答下列问题:
(1)主要反应装置如上图,a处缺少的装置是____ (填仪器名称),实验步骤③和④的分液操作中使用到下列仪器中的_____(填标号)。
a.烧杯 b.漏斗 c.玻璃棒 d.铁架台
(2)步骤②中用5%的碳酸钠溶液调pH =7~8的目的之一是使Fe3+ 转化为氢氧化铁沉淀,另一个目的是 ____。
(3)步骤③中液体M是分液时的____ 层(填“上”或“下”)液体,加入盐酸的作用是____。
(4)步骤④中加入氢氧化钠溶液后发生反应的离子方程式有____。
(5)步骤⑤中,以下洗涤剂中最合适的是____ (填标号)。
a.乙醇 b.蒸馏水 c.HCl溶液 d.NaOH溶液
(6)本实验的产率是_____%。(计算结果保留一位小数)
【答案】球形冷凝管 ad 使对甲基苯胺盐酸盐转化为对甲基苯胺 上 与对甲基苯胺转化为对甲基苯胺盐酸盐进入水层与对硝基甲苯的分离 H++OH-=H2O、![]() +OH-
+OH-![]()
![]() +H2O b 57.0%
+H2O b 57.0%
【解析】
首先向三颈烧瓶中加稀盐酸、对硝基甲苯和适量铁粉加热进行反应,生成对甲基苯胺盐酸盐,调节pH=7~8,沉淀铁离子并使对甲基苯胺盐酸盐转化为对甲基苯胺,加入苯溶解生成的对甲基苯胺和未反应的对硝基甲苯,抽滤静置分液得到有机层,向有机层中加入盐酸使对甲基苯胺转化为对甲基苯胺盐酸盐,生成的对甲基苯胺盐酸盐易溶于水,静置分液得到无机层,向无机层加入NaOH溶液,使对甲基苯胺盐酸盐转化为对甲基苯胺,对甲基苯胺常温下为不溶于水的固体,所以在加入氢氧化钠溶液后会有对甲基苯胺固体析出,抽滤得到固体,洗涤、干燥得到产品。
(1)该反应中反应物沸点较低,加热反应过程中会挥发,需要在a处加装球形冷凝管冷凝回流;分液操作需要烧杯、分液漏斗、铁架台,所以选ad;
(2)根据题目所给信息可知,pH值升高会使对甲基苯胺盐酸盐转化为对甲基苯胺,达到分离提纯的目的;
(3)根据分析步骤③中液体M为有机层,溶剂为苯,密度比水小,所以在上层;加入盐酸使对甲基苯胺转化为易溶于水的对甲基苯胺盐酸盐,从而实现与对硝基甲苯的分离;
(4)下层液体中有未反应的盐酸和生成的对甲基苯胺盐酸盐都与NaOH发生反应,离子方程式为:H++OH-=H2O、![]() +OH-
+OH-![]()
![]() +H2O;
+H2O;
(5)洗涤过程是为了洗去对甲基苯胺可能附着的对甲基苯胺盐酸盐、NaCl和NaOH等可溶于水的杂质,为降低对甲基苯胺洗涤过程的溶解损失,最好的洗涤剂应为蒸馏水,所以选b;
(6)原料中有13.7g对硝基甲苯,即![]() =0.1mol,所以理论上生成的对甲基苯胺应为0.1mol,实际得到产品6.1g,所以产率为
=0.1mol,所以理论上生成的对甲基苯胺应为0.1mol,实际得到产品6.1g,所以产率为![]() =57.0%。
=57.0%。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
键能(kJ·mol-1) | 243 | a | 607 | 630 |
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___kJmol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___。
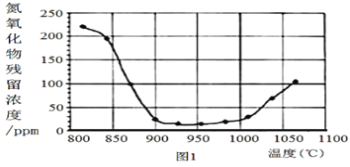
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___(填序号)
a.<850℃ b.900~1000℃ c.>1050℃
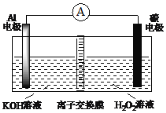
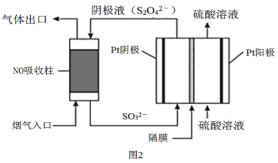
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___。
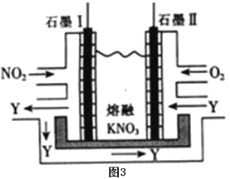
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___。