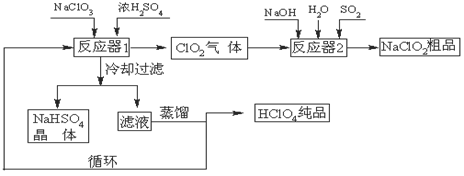
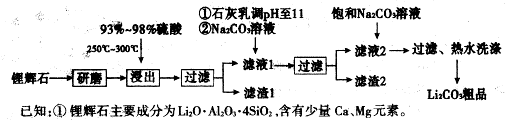
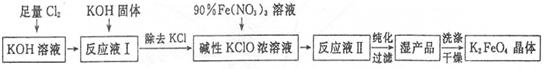
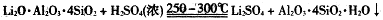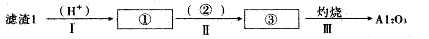题目内容
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。

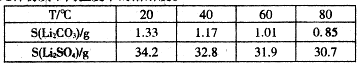
已知以下四种物质的溶解度曲线图:
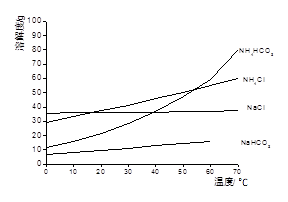
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。

已知以下四种物质的溶解度曲线图:
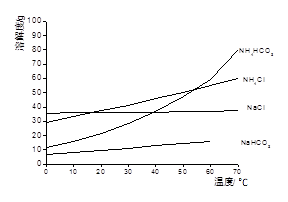
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
(16分)(1)Mg (OH)2(2分) CaCO3(2分)
(2)NaHCO3(3分)
(3)除去HCO3-(3分,多答“使更多的Na+形成NaCl析出,提高NH4Cl的纯度”不扣分) NaCl(3分)
(4)NaHCO3+SO2 = NaHSO3+ CO2(3分)
(2)NaHCO3(3分)
(3)除去HCO3-(3分,多答“使更多的Na+形成NaCl析出,提高NH4Cl的纯度”不扣分) NaCl(3分)
(4)NaHCO3+SO2 = NaHSO3+ CO2(3分)
试题分析:(1)依题意,除杂步骤涉及的反应为Ca(OH)2+Mg2+=Mg(OH)2+Ca2+,CO2+2NH3?H2O=2NH4++CO32-+H2O,Ca2++CO32-=CaCO3↓,则废渣的主要成分是Mg(OH)2、CaCO3;(2)由溶解度曲线可知,NaHCO3的溶解度最小,最先达到饱和,则NH4HCO3与饱和NaCl具备发生复分解反应发生的条件,即NH4HCO3+NaCl=NaHCO3↓+NH4Cl,因此滤渣1的主要成分是NaHCO3;(3)过滤后滤液1中的主要成分是NaCl、NH4Cl、NaHCO3,氯化纳和氯化铵都不能与盐酸反应,而碳酸氢钠与盐酸能反应,即HCO3-+H+=CO2↑+H2O,因此加入足量盐酸能除去HCO3-,提高NH4Cl的纯度;由溶解度曲线可知,热溶液中NaCl的溶解度小于NH4Cl,因此蒸发浓缩、趁热过滤得到的滤渣2为NaCl,而滤液则含有NH4Cl、NaCl;由于NH4Cl的溶解度随温度降低明显减小,而NaCl的溶解度随温度降低无明显变化,则蒸发浓缩、冷却结晶可制备NH4Cl晶体;(4)滤渣1为NaHCO3,根据表中的电离常数可知电离程度:H2SO3>H2CO3>HSO3->HCO3-,根据复分解反应发生的条件可知,通入SO2的反应为NaHCO3+SO2=NaHSO3+CO2,不可能为2NaHCO3+SO2=Na2SO3+2CO2+H2O,因为CO2+H2O+Na2SO3= NaHSO3+NaHCO3。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目