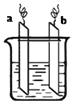
题目内容
【题目】下列实验操作不正确的是
A.  实验室中制取少量的乙酸乙酯 B.
实验室中制取少量的乙酸乙酯 B.  比较硫、碳、硅三种元素的非金属性强弱
比较硫、碳、硅三种元素的非金属性强弱
C.  处理尾气 D.
处理尾气 D.  测定黄铜(Cu、Zn合金)中的Zn含量
测定黄铜(Cu、Zn合金)中的Zn含量
【答案】A
【解析】A.乙酸乙酯在碱性条件下水解,应用饱和碳酸钠溶液吸收,且导管不能插入液面下,防止倒吸,故A错误;B.若锥形瓶中生成气体,说明硫酸的酸性比碳酸强,烧杯中生成白色沉淀,说明碳酸的酸性比硅酸强,最高价氧化物对应水化物酸性越强,则对应元素的非金属性越强,因此比较硫、碳、硅非金属性强弱的实验方案合理,故B正确;C.氨气易溶于硫酸,难溶于四氯化碳,四氯化碳的密度比硫酸溶液大,导管口伸入下层液体可以防止倒吸,逸出的氨气被稀硫酸完全吸收生成铵盐,故C正确;D.在金属活动性顺序表中,锌是氢前金属,铜是氢后金属,前者与稀盐酸发生置换反应,生成的氢气难溶于水,水还能除去氢气中混有的氯化氢,排水量气法收集氢气,根据氢气的体积可以计算完全反应的锌的质量,进而可以求黄铜中锌的含量,故D正确;故选A。

练习册系列答案
相关题目
【题目】在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)![]() (CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
(CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |

下列说法正确的是( )
A. 该反应的△H<0,图中压强p1>p2
B. 达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C. 达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D. 达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍