题目内容
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:
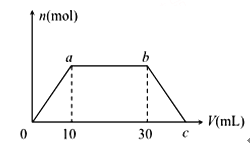
(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
【答案】 Ba2++2OH-+CO2==BaCO3↓+H2O 2OH-+CO2==CO32-+H2O、CO32-+CO2+H2O==2HCO3- BaCO3+CO2+H2O==Ba2++2HCO3- 40 1:2
【解析】试题分析:本题考查离子方程式的书写和有关图像的计算。向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,随着CO2的通入依次发生的反应为:CO2+Ba(OH)2=BaCO3↓+H2O、CO2+2NaOH=Na2CO3+H2O、CO2+Na2CO3+H2O=2NaHCO3、CO2+BaCO3+H2O=Ba(HCO3)2。
(1)0到a点之间CO2与Ba(OH)2反应生成BaCO3沉淀,离子方程式为:CO2+Ba2++2OH-=BaCO3↓+H2O。
(2)a点到b点之间CO2与NaOH反应先生成Na2CO3,继续通入CO2与Na2CO3反应生成NaHCO3,反应的离子方程式为:CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-。
(3)b点之后通入的CO2将a点前生成的BaCO3转化为可溶于水的Ba(HCO3)2,反应的离子方程式为:BaCO3+CO2+H2O=Ba2++2HCO3-。
(4)根据反应:CO2+Ba(OH)2=BaCO3↓+H2O和CO2+BaCO3+H2O=Ba(HCO3)2,b点到c点消耗的CO2与0到a点消耗的CO2相等,则同温同压下b点到c点消耗的CO2的体积也为10mL,则c点CO2的体积为30mL+10mL=40mL。
(5)根据0到a点反应CO2+ Ba(OH)2=BaCO3↓+H2O消耗CO2的体积为10mL,a点到b点之间反应CO2+NaOH=NaOH消耗CO2的体积为20mL,同温同压下气体的体积之比等于气体物质的量之比,则Ba(OH)2与NaOH物质的量之比为1:2。
