题目内容
【题目】把一块镁铝合金(质量为m g)投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是
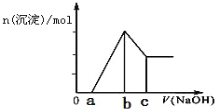
A. 假设a=25,整个反应过程中,主要发生了6个离子反应
B. c值越大,合金中Mg的含量越高
C. b值越大,合金中Al的含量越高
D. 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应
【答案】A
【解析】
根据图可知,往溶液里加入NaOH溶液,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=AlO2-+2H2O。
A项、假设a=25,整个反应过程中,主要发生了镁、铝与氢离子2个反应和0→a:H++OH-=H2O、a→b:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=AlO2-+2H2O,共6个离子反应,故A正确;
B项、c值越大,说明氢氧化铝消耗氢氧化钠的量越大,所以氢氧化铝的量越多,则合金中Al的含量越高,故B错误;
C项、b值越大,合金中Al的含量越高,说明c-b的值越小,所以氢氧化铝的量越小,则合金中Al的含量越小,故C错误;
D项、镁铝合金与50mL1mol/L的HCl反应,盐酸过量,故D错误。
故选A。

【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是

选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D