��Ŀ����
����Ŀ��50 mL 0.50 mol��L-1 ������ 50 mL 0.55 mol��L -1 NaOH ��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����е������ɼ����к��ȡ��ش��������⣺
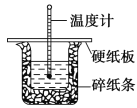
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��____________________
��2���ձ���������ֽ����������______________________ ��
��3��������ѡ����ѡ������NaOH��Һ����ȷ����________
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ��______ (�ƫ ����ƫС������Ӱ�족)��
��5��ʵ���и���60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ���з�Ӧ��������ʵ����ȣ����ų�������________����������С�����䡱���������к���________����������С�����䡱��
��6����50 mL 0.50 mol��L-1 CH3COOH ��Һ(��֪CH3COOH ����ʱ����)��������ʵ�飬��õ��к��ȵ���ֵ��________��(�ƫ����ƫС������Ӱ�족)
���𰸡����β�������� ���¸��ȣ�������������ʧCƫС���ƫС
��������
(1)���������Ĺ����֪��װ��ȱ�ٵ�����Ϊ���β���������� (2)�к��Ȳⶨʵ��Ĺؼ��DZ��¹�������С�ձ�֮��������ֽ���������DZ��¸��ȣ�������������ʧ��(3)Ϊ����ȷ�ⶨ��Ӧ�����е��¶ȱ仯��������Ҫ������������Һһ�μ��룬ѡC��(4). ���ձ����������Ӳֽ�壬��ʹһ����������ʧ����õ��к�����ֵ�����С��(5)��Ӧ�ų����������������Լ�������Ķ����йأ�����60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������ӣ����ų�������ƫ�ߣ������к��ȶ���ǿ���ǿ������1molˮʱ�������������������أ����Ը���60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ����ʵ�飬�ⶨ�к�����ֵ���䡣(6). ��50 mL 0.50 mol��L-1 CH3COOH ��Һ����ΪCH3COOH ����ʱ���ȣ���������ͬŨ�Ⱥ�����Ĵ���������ᣬ��Ӧ�ų�������ƫС��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ�������£����и���������һ��ʵ��ͼ����ʾת����ϵ����

ѡ�� | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D