题目内容
【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
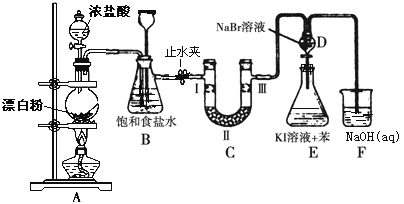
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。
【答案】Ca(ClO)2+4HCl![]() CaCl2+Cl2↑+2H2O 观察后面管道是否堵塞 作储气瓶 2 E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+
CaCl2+Cl2↑+2H2O 观察后面管道是否堵塞 作储气瓶 2 E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+
【解析】
装置A的作用是漂粉精中的次氯酸钙与浓盐酸反应制备氯气;装置B的作用是除去氯气中混有的氯化氢气体,同时还可以利用长颈漏斗中液面的观察是否堵塞,关闭止水夹,还可以起到储存氯气的作用;装置C的作用是利用有色布条是否褪色验证氯气是否具有漂白性;装置D的作用是通过观察溴化钠和碘化钾是否反应比较氯、溴、碘的非金属性;装置F的作用是吸收过量氯气,防止污染环境。
(1)漂粉精的有效成分Ca(ClO)2具有强氧化性,Ca(ClO)2与浓盐酸反应生成Cl2,反应的化学方程式为Ca(ClO)2+ 4HCl(浓)= CaCl2+2Cl2↑+ 2H2O,故答案为:Ca(ClO)2+ 4HCl(浓)= CaCl2+2Cl2↑+ 2H2O;
(2)装置B中饱和食盐水可以除去氯气中混有的氯化氢气体;打开止水夹,如果C中发生堵塞,B中压强增大,则B中长颈漏斗中液面上升,形成水柱,可以观察是否堵塞;关闭止水夹,可以通过长颈漏斗中液面的变化,储存少量的氯气,起到储气瓶的作用,故答案为:观察后面管道是否堵塞;作储气瓶;
(3)为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故d项正确,故答案为:d;
(4)装置D中试剂为溴水,加入到E中,Br2与I反应生成I2,所以实验现象为:E中溶液分为两层,上层(苯层)为紫红色;Cl2通入D与NaBr反应生成Br2,可能会有Cl2剩余,所以把D中溶液加入到E中,也有可能是Cl2将I氧化为I2,因此不能说明溴单质的氧化性强于碘,故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能;过量的Cl2也可将I-氧化为I2;
(5)Cl2具有较强氧化性,能与Na2S2O3溶液发生氧化还原反应反应生成硫酸钠、氯化氢和水,反应的离子方程式为:S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+,故答案为:S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案