题目内容
【题目】以甲苯和有机物A为原料,合成高分子化合物M的一种路线如下(部分反应条件略去):

已知:①A的实验式为CH3O
② (-NH2容易被氧化)
(-NH2容易被氧化)
③
④ (R和R’代表烃基)
(R和R’代表烃基)
请回答下列问题:
(1)A的化学名称为_______________,检验B中所含官能团的试剂名称为____________。
(2)G的顺式结构简式为________________、____________。
(3)D→E,H→I的反应类型分别为______________________。
(4)C+J→M的化学方程式为____________________________。
(5)同时满足下列条件的F的同分异构体有_____________种(不考虑立体异构)。
①含有![]()
②两个—NO2分别连在两个不同的苯环上
F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器为_______(填选项字母)
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振仪
(6)参照上述合成路线和信息,以乙醇和硝基苯为有机原料(无机试剂任选),设计制备![]() 的合成路线____________________。
的合成路线____________________。
【答案】 乙二醇(或1,2-乙二醇) 银氨溶液[或新制Cu(OH)2悬浊液] 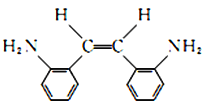 取代反应(或硝化反应) 加成反应
取代反应(或硝化反应) 加成反应  5 A
5 A 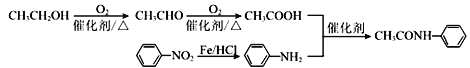
【解析】根据M的结构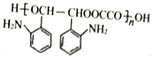 可知,M的单体为
可知,M的单体为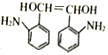 和HOOCCOOH,结合A的实验式为CH3O知A为乙二醇,B为乙二醛,C为乙二酸;D为甲苯,甲苯发生硝化反应生成E,结合H知,E为邻硝基甲苯,根据信息④,G为
和HOOCCOOH,结合A的实验式为CH3O知A为乙二醇,B为乙二醛,C为乙二酸;D为甲苯,甲苯发生硝化反应生成E,结合H知,E为邻硝基甲苯,根据信息④,G为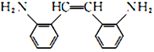 ,根据信息②和③,结合-NH2容易被氧化,则F为
,根据信息②和③,结合-NH2容易被氧化,则F为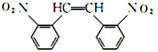 ,H与溴发生加成反应生成I,I水解生成J。
,H与溴发生加成反应生成I,I水解生成J。
(1)根据上述分析,A为乙二醇,B为乙二醛,可以用银氨溶液平[或新制Cu(OH)2悬浊液]检验B中的醛基,故答案为:乙二醇(或1,2-乙二醇) (2). 银氨溶液平[或新制Cu(OH)2悬浊液] ;
(2)G为 ,其顺式结构简式为
,其顺式结构简式为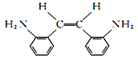 ,故答案为:
,故答案为: ;
;
(3)根据上述分析,D→E为硝化反应,H→I为加成反应,故答案为:取代反应(或硝化反应);加成反应;
(4)C+J→M的化学方程式为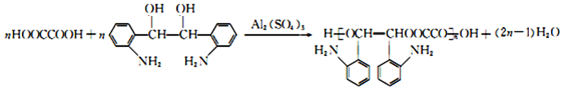 ,故答案为:
,故答案为: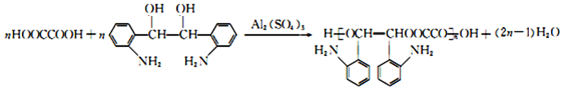 ;
;
(5)F为 ,同时满足:①含有
,同时满足:①含有![]() ;
;
②两个—NO2分别连在两个不同的苯环上,的F的同分异构体有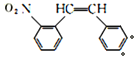 (●为另一个硝基可能的位置)2种;
(●为另一个硝基可能的位置)2种;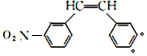 2种;
2种;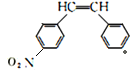 ,共5种,F的所有同分异构体含有相同的元素,在元素分析仪中显示的信号(或数据)完全相同故答案为:5;A;
,共5种,F的所有同分异构体含有相同的元素,在元素分析仪中显示的信号(或数据)完全相同故答案为:5;A;
(6)以乙醇和硝基苯为有机原料合成![]() 。可以先合成苯胺和乙酸,乙酸可以有乙醇合成,苯胺可以有硝基苯合成,合成路线为:
。可以先合成苯胺和乙酸,乙酸可以有乙醇合成,苯胺可以有硝基苯合成,合成路线为: ,故答案为:
,故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】(M分)研究碳、氮及其化合物的转化对于环境的改善有重大意义。氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为_________________。
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:_____________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。己知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈_____(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_____________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为_________(填“吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将__________(填“增大”“减小”或“不变”)。
③计算反应体系在335℃时的平衡常数_______________。
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=_____ mol·L-1(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)


