题目内容
【题目】碳、镁、镍在工业生产和科研领域有广泛用途。请回答下列问题:
(1)基态碳原子中,能量最高的电子所占用的能级符号为_________;该能级中原子轨道的电子云形状为______________________。
(2)从石墨中可剥离出由单层碳原子构成的石墨烯,石墨烯中碳原子和共价键的数目之比为________。
(3)Mg2+能形成多种配合物和配离子,如Na4[Mg(PO3)4]、Mg[EDTA]2- EDTA的结构简式为( )等。
)等。
①PO3-的立体构型为____________,其中心原子的杂化轨道类型为__________,其中杂化轨道的作用为__________________________。
② 是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
(4)晶体镁的堆积模型为____________;其中镁原子的配位数为______________。
(5)碳、镁、镍形成的某晶体的晶胞结构如图所示。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数a=___________pm(用代数式表示)。

【答案】 2p 哑铃形(或纺锤形) 2:3 平面三角形 sp2 形成α键 C<O<N CNO- 六方最密堆积 12 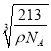
![]() 1010
1010
【解析】(1)基态碳原子核外有2个电子层,能量最高的电子所占用的能级符号为2p;该能级中原子轨道的电子云形状为纺锤形,故答案为:2p;纺锤形;
(2)石墨烯中每个碳原子与周围的3个碳原子通过共价键结合,每个碳原子含有![]() 个共价键,因此碳原子和共价键的数目之比为1:
个共价键,因此碳原子和共价键的数目之比为1: ![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(3)①PO3-中P原子的价层电子对数=3+![]() ×(5+1-2×3)=3,P原子采用sp2杂化,立体构型为平面三角形,其中杂化轨道形成σ键,故答案为:平面三角形; sp2;形成σ键;
×(5+1-2×3)=3,P原子采用sp2杂化,立体构型为平面三角形,其中杂化轨道形成σ键,故答案为:平面三角形; sp2;形成σ键;
②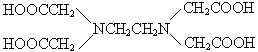 是常用的分析试剂。其中位于同周期的三种基态原子为C、N、O,由于N原子的2p为半充满结构,较为稳定,第一电离能由小到大的顺序为C<O<N;这三种元素形成的一种离子与CS2互为等电子体,该离子为CNO-,故答案为:C<O<N ;CNO-;
是常用的分析试剂。其中位于同周期的三种基态原子为C、N、O,由于N原子的2p为半充满结构,较为稳定,第一电离能由小到大的顺序为C<O<N;这三种元素形成的一种离子与CS2互为等电子体,该离子为CNO-,故答案为:C<O<N ;CNO-;
(4)晶体镁的堆积模型为六方最密堆积;其中镁原子的配位数为12,故答案为:六方最密堆积;12;
(5)该晶胞中C原子个数=1,Mg原子个数=8×![]() =1,Ni原子个数=6×
=1,Ni原子个数=6×![]() =3,1mol晶胞的质量为12+24+59×3=213g,则ρg·cm-1=
=3,1mol晶胞的质量为12+24+59×3=213g,则ρg·cm-1=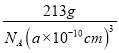 ,解得a=
,解得a=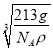 ×1010pm,故答案为:
×1010pm,故答案为: 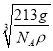 ×1010。
×1010。

【题目】几种短周期元素的原子半径及主要化合价如下表:
元素符号 | A | B | C | D | E |
原子半径(nm) | 0.160 | 0.080 | X | 0.143 | 0.074 |
主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
则X可能的数值为
A. 0.069 B. 0.102 C. 0.145 D. 0.184





