��Ŀ����
����Ŀ��CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1��CO��Cl2�ڴ����������ºϳɹ�����COCl2����ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2���ڴ����������·�����Ӧ��CO��g��+Cl2��g��![]() COCl2��g�� ��H =a kJ/mol��Ӧ�����вⶨ�IJ����������±�:
COCl2��g�� ��H =a kJ/mol��Ӧ�����вⶨ�IJ����������±�:

�ٷ�Ӧ0��2minĩ��ƽ������v��COCl2��=_______mol/��L��min����
����2min��4min�䣬v��Cl2����______v��Cl2���� ���>������=����<������ ���¶���K =_______L/ mol��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
X��������������__________��a_________0 ���>������=������<������

��2���ڴ���������NO��COת��Ϊ�����壺
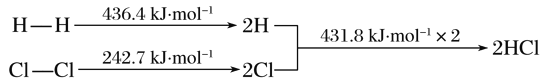
2CO��g����2NO��g��![]() 2CO2��g����N2��g�� ��H=��748 kJ��mol-1
2CO2��g����N2��g�� ��H=��748 kJ��mol-1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ��NOת������ͼ1��ʾ���¶ȸ���710Kʱ�����¶ȵ�����NOת���ʽ��͵�ԭ�������____________________��
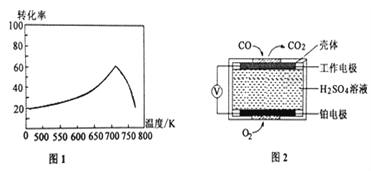
����֪���ⶨ������NO��CO�������õķ��������֣�����1���绯ѧ������������������CO�������Ĺ���ԭ����ͼ2��ʾ�������缫�ķ�ӦʽΪ________________������2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ�ᣬ������к͵ζ����ⶨǿ��Ũ�ȡ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ______________________��
��3��һ�������£���CO��H2����2L�ܱ������з�Ӧ�������ɼ���(CH3OCH3)��
4H2(g)��2CO(g)![]() CH3OCH3(g)��H2O(g) ��H��0
CH3OCH3(g)��H2O(g) ��H��0
�������жϷ�Ӧ�ﵽƽ�����_______________��
A����(H2)��2��(CO) B�������ڵ�ѹǿ����
C�����������ܶȲ��� D����������ƽ����Է�����������
E�����ѵ�Ũ�ȱ��ֲ���
���𰸡� 0.1 = 5 �¶� < �¶����ߵ�710Kʱ����Ӧ�ﵽƽ��״̬�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����������ת���ʽ��� CO-2e��+H2O��CO2+2H+ 2NO+3H2O2��2NO3��+2H2O+2H+ BDE
����������1�����ɱ������ݣ���֪0��2min����n��CO��=1.2mol-0.8mol=0.4mol���ɷ���ʽ��֪��c��COCl2��=��c��CO��=0.4mol����v��COCl2��=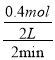 =0.1mol/��L��min������4min�ڣ���Ӧ������Ϊ0.6mol-0.2mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��COΪ0.4mol����4minʱCOΪ1.2mol-0.4mol=0.8mol����2minʱCO�����ʵ�����ȣ���2min��4min����ƽ��״̬����2min��4min�䣬v��Cl2���� =v��Cl2�������ɷ���ʽ��֪��ƽ��ʱ����COCl2Ϊ0.4mol�����¶���ƽ�ⳣ��K=
=0.1mol/��L��min������4min�ڣ���Ӧ������Ϊ0.6mol-0.2mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��COΪ0.4mol����4minʱCOΪ1.2mol-0.4mol=0.8mol����2minʱCO�����ʵ�����ȣ���2min��4min����ƽ��״̬����2min��4min�䣬v��Cl2���� =v��Cl2�������ɷ���ʽ��֪��ƽ��ʱ����COCl2Ϊ0.4mol�����¶���ƽ�ⳣ��K=![]() =
=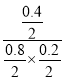 =5��������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ�����ӦΪ���ȷ�Ӧ����a��0����2���ٵ��¶����ߵ�710Kʱ����λʱ���ڷ�Ӧ��ƽ�⣬���ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ת���ʽ��ͣ��ڸ�װ����ԭ��أ�ͨ��һ����̼�ĵ缫�Ǹ�����������һ����̼ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CO-2e-+H2O��CO2+2H+��NO��H2O2��Һ������ǿ�����ᣬ˫��ˮ����ԭ��ˮ����Ӧ�����ӷ���ʽ2NO+3H2O2��2NO3-+2H2O+2H+����3��A����(H2)��2��(CO)û��ע����Ӧ���ʵķ���һ������ƽ��״̬��A����B������Ӧ�����С����������ڵ�ѹǿ����˵����Ӧ����ƽ��״̬��B��ȷ��C���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˻��������ܶȲ��䲻һ������ƽ��״̬��C����D���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����Ի�������ƽ����Է�����������˵������ƽ��״̬��D��ȷ���ţ����ѵ�Ũ�ȱ��ֲ���˵����Ӧ����ƽ��״̬��E��ȷ����ѡBDE��
=5��������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���COת��������ͼ����X����ʱ��CO��ƽ��ת���ʽ��ͣ�ƽ�������ƶ�����XΪ�¶ȣ�����ӦΪ���ȷ�Ӧ����a��0����2���ٵ��¶����ߵ�710Kʱ����λʱ���ڷ�Ӧ��ƽ�⣬���ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ת���ʽ��ͣ��ڸ�װ����ԭ��أ�ͨ��һ����̼�ĵ缫�Ǹ�����������һ����̼ʧ���ӷ���������Ӧ���缫��ӦʽΪ��CO-2e-+H2O��CO2+2H+��NO��H2O2��Һ������ǿ�����ᣬ˫��ˮ����ԭ��ˮ����Ӧ�����ӷ���ʽ2NO+3H2O2��2NO3-+2H2O+2H+����3��A����(H2)��2��(CO)û��ע����Ӧ���ʵķ���һ������ƽ��״̬��A����B������Ӧ�����С����������ڵ�ѹǿ����˵����Ӧ����ƽ��״̬��B��ȷ��C���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ���˻��������ܶȲ��䲻һ������ƽ��״̬��C����D���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ����Ի�������ƽ����Է�����������˵������ƽ��״̬��D��ȷ���ţ����ѵ�Ũ�ȱ��ֲ���˵����Ӧ����ƽ��״̬��E��ȷ����ѡBDE��