题目内容
【题目】稀土金属是我国战略性资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料。其中一种提取铈的工艺流程如下:

已知:焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物;+ 4价的铈的氧化物有很强的氧化性,通常在酸性条件下易被还原剂还原成+3价而溶于水。请回答下列问题
(1)酸浸l中所用的酸A为(用字母表示)________(a.盐酸 b.稀硫酸),原因是_______。
(2)酸浸Ⅱ后,为避免三价铈以四氟硼酸盐形式损失,需用可溶性钾盐将四氟硼酸根离子沉淀除去,该反应的离子方程式为___________。
(3)实验室中进行萃取操作所用到的主要玻璃仪器名称是________;在操作I后的溶液中加入NaOH溶液是为了调节溶液pH 获得Ce(OH)3和_______,测定该溶液pH的操作是_______。
(4)写出氧化步骤的化学方程式_______________。
【答案】 b 防止+4价的CeO2在酸性环境下被Cl-还原成+3价溶于浸出液中而无法分离 K++BF4-=KBF4↓ 分液漏斗 Ce(OH)4 撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
【解析】(1)因CeO2有强氧化性,防止+4价的CeO2在酸性环境下被Cl-还原成+3价溶于浸出液中而无法分离,故酸浸l中所用的酸A为硫酸,即答案为b;
(2)根据题意可知应为KBF4沉淀,则用可溶性钾盐将四氟硼酸根离子沉淀除去时发生反应的离子方程式为K++BF4-=KBF4↓;
(3)萃取分液操作所用到的主要玻璃仪器是分液漏斗 ;加入NaOH溶液是为了调节溶液pH ,使Ce3+和Ce4+沉淀,获得Ce(OH)3和Ce(OH)4 ,测定该溶液pH的操作是撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比;
(4)NaClO将Ce(OH)3氧化为Ce(OH)4,其中NaCl为还原产物,发生反应的化学方程为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl。

【题目】Ⅰ、在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________________。
(2)如图中表示NO2的变化的曲线是____________。
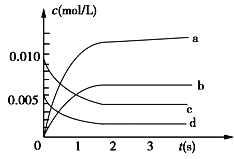
(3)能说明该反应已达到平衡状态的是____________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是____________。
a.及时分离出NO2气体 b.适当升高温度
c.增大容器的容积 d.选择高效催化剂
Ⅱ、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
(1)铅蓄电池的负极材料是____________。
(2)工作时,电解质溶液的酸性____________(填“增大”、“减小”或“不变”)。
(3)工作时,电解质溶液中阴离子移向____________极。
(4)外电路中,电流方向从____________极流向____________极。
【题目】为探究Na2SO3溶液的性质,某学习小组设计了一系列实验,并记录实验现象。具达如下表所示。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2mol/LNa2SO3溶液 | 品红溶液 | 红色消失 |
② | 饱和Ag2SO4举泫 | 产生白色沉淀 | ||
③ | 0.2mol/L CuSO4溶液 | 溶液先变绿,继续滴加产生砖红色沉淀 | ||
④ | 0.lmol/L Al2(SO4)溶液 | 开始无明显现象,继续滴加产生白色沉淀,并有刺激性气味的气体生成 |
则以下说法不正确的是( )
A. Na2SO3溶液具有漂白性
B. Ksp(Ag2SO4)<Ksp(Ag2SO3)
C. 实验③,SO32-与Cu2+发生了氧化还原反应
D. 实验④发生反应的离子方程式为:3SO32-+2Al3++3H2O=2Al(OH)3↓+3SO2↑
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:① KMnO4/H+ ② NaOH溶液 ③ 饱和Na2CO3溶液 ④ H2O
⑤ Na ⑥ Br2/H2O ⑦ Br2/CCl4
Ⅱ.装置: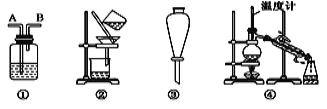
选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
A. A B. B C. C D. D