题目内容
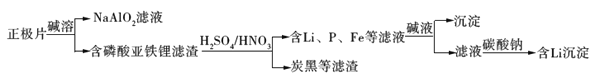
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li、C
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
【答案】BD
【解析】
正极片经碱溶可得到NaAlO2,可说明含有Al元素,含有磷酸亚铁锂的滤渣加入硫酸、硝酸,可除去炭黑等,得到含有P、Fe、Li的滤液,加入碱液,生成的沉淀为Fe(OH)3,滤液加入碳酸钠,可生成碳酸锂沉淀,据此分析解答。
A.废旧电池会污染土壤和水体,合理处理废旧电池,可减少污染,且回收含有Al、Fe等金属,可节约资源,故A正确;
B.由以上分析可知从“正极片”中可回收的金属元素有Al、Fe、Li等,C属于非金属,故B错误;
C.硝酸具有强氧化性,可氧化亚铁离子生成铁离子,则“沉淀”反应的金属离子为Fe3+,故C正确;
D.硫酸锂易溶于水,加入硫酸钠,不能生成含Li沉淀,故D错误;
答案选BD。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。




