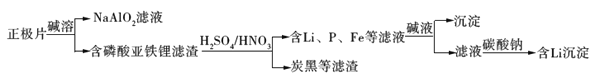
题目内容
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
【答案】ΔH2 -3ΔH1 2NH3 -6e-+6OH-=N2 +6H2O 0.06mol/(Lmin) AC 增大 0.11或1/9 ClO2-+H2O![]() HClO2+OH- 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O
HClO2+OH- 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O
【解析】
(1)根据盖斯定律:②-①×3,可计算出所求反应的△H;燃料电池中,氨气在负极发生氧化反应,在碱性环境下生成氮气,据此写出负极极反应方程式。
(2)①根据表中信息可以先计算出v(N2),然后根据速率之比和系数成正比规律得出v(NO2);
②A.混合气体颜色不再变化,NO2(g)浓度不变,据此进行判断平衡与否;
B.根据ρ=m/V判断平衡与否;
C.根据![]() =m(总)/n(总) 判断平衡与否;
=m(总)/n(总) 判断平衡与否;
③在恒温恒容的容器内发生可逆反应达平衡后,在原平衡基础上,同比例增加反应的量(或浓度),等效于加压过程,据此分析;
④先根据三段式,求出平衡时各物质的浓度,然后根据K=c4(CO2)c(N2)/c4(CO)c2(NO2)进行计算;
(3)①NaClO2 属于强碱弱酸盐,水解显碱性;
②根据表中信息可以求出:n(NO3-)、n(NO2-)和n(Cl-)系数比,根据原子守恒规律,可以求出n(NO)与n(NaClO2)系数比,最后根据电荷守恒,原子守恒写出该反应的离子方程式。
(1)根据盖斯定律:②-①×3,可得到4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=△H2-3 △H1;燃料电池中,氨气在负极发生氧化反应,在碱性环境下生成氮气,负极电极反应:2NH3-6e-+6OH-=N2+6H2O;综上所述,本题答案是:ΔH2-3ΔH1 ;2NH3-6e-+6OH-=N2 +6H2O 。
(2)①0~5min,c(N2)变化了0.15mol/L,则v(N2)=0.15/5=0.03 mol/(Lmin),根据速率之比和系数成正比规律可知,v(NO2)=2v(N2)= 0.06 mol/(Lmin) ;综上所述,本题答案是:0.06 mol/(Lmin)。
②A.NO2(g)为红棕色,混合气体颜色不再变化,NO2(g)浓度不变,反应达到平衡状态,正确;
B.反应前后混合气体的质量不变,恒容密闭容器中,体积不变,所以气体密度恒为定值,不能判断反应是否达到平衡状态,错误;
C.反应前后混合气体的质量不变,反应后混合气体的总量减小,当混合气体平均相对分子质量不再变化时,反应达到平衡状态,正确;
综上所述,本题选AC。
③20 min时,反应达到平衡状态,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,按比例增加反应物,相对于原平衡来说等效于加压过程,4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)平衡右移,在t1时反应再次达到平衡,则NO2的转化率比原平衡增大;综上所述,本题答案是:增大;
N2(g)+4CO2(g)平衡右移,在t1时反应再次达到平衡,则NO2的转化率比原平衡增大;综上所述,本题答案是:增大;
④ 根据表中信息可知
4CO(g) + 2NO2(g) ![]() N2(g)+4CO2(g)
N2(g)+4CO2(g)
起始浓度 2 2 0 0
变化浓度 1 0.5 0.25 1
平衡浓度 1 1.5 0.25 1
该温度下反应的化学平衡常数K=c4(CO2)c(N2)/c4(CO)c2(NO2)= 14×0.25/ 14×(1.5)2=1/9;综上所述,本题答案是:0.11或1/9 。
(3)①NaClO2 属于强碱弱酸盐,水解显碱性,离子方程式为ClO2-+H2O![]() HClO2+OH-;综上所述,本题答案是:ClO2-+H2O
HClO2+OH-;综上所述,本题答案是:ClO2-+H2O![]() HClO2+OH-。
HClO2+OH-。
②设溶液的体积为1L,根据氮原子守恒可知:n(NO)=n(NO3-)+n(NO2-)=3.0×10-4,根据氯原子守恒可知:n(NaClO2)= n(Cl-)=1.75×10-4;因此n(NO):n(NaClO2)= 3.0×10-4:1.75×10-4=12:7,n(NO3-):n(NO2-):n(Cl-)=2.0×10-4:1.0×10-4:1.75×10-4=8:4:7,再根据电荷守恒,原子守恒,得出NaClO2溶液脱硝过程中发生总反应的离子方程式:12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O;综上所述,本题答案是:12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强