题目内容
20.利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁.其生产步骤如下: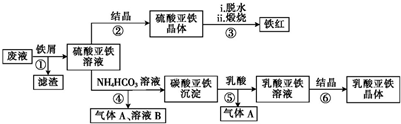
已知:TiOSO4可溶于水,在水中可以电离出TiO2+和SO42-.
请回答下列问题:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是过滤.
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4.
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的化学方程式为4FeSO4+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO3.
(4)步骤④的离子方程式是Fe2++2HCO3-═FeCO3↓+H2O+CO2↑.
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及防止Fe2+被氧化.
(6)为了测定步骤②所得晶体中FeSO4•7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(假设杂质与KMnO4不反应).若消耗0.1000mol•L-1的KMnO4溶液20.00mL,则所得晶体中FeSO4•7H2O的质量分数为$\frac{13.9}{a}$(用含a的代数式表示).
分析 废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体,
(1)实现固体和液体的分离用过滤的方法;
(2)根据水解原理:盐+水=酸+碱,结合水解产物是TiO2•xH2O来书写;
(3)根据氧化还原实质书写化学方程式,反应是硫酸亚铁和氧气反应生成铁红和三氧化硫;
(4)亚铁离子可以和碳酸氢根离子之间反应生成碳酸亚铁沉淀;
(5)亚铁离子易被氧气氧化;
(6)根据元素守恒和电子守恒,即5FeSO4•7H2O~KMnO4,计算FeSO4•7H2O的质量分数.
解答 解:废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体,
(1)分离硫酸亚铁溶液和滤渣的操作是过滤,故答案为:过滤;
(2)TiOSO4水解生成TiO2•xH2O的化学方程式为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4,故答案为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4;
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:4FeSO4+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO3,故答案为:4FeSO4+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO3;
(4)步骤④的离子方程式是Fe2++2HCO3-═FeCO3↓+H2O+CO2↑,故答案为:Fe2++2HCO3-═FeCO3↓+H2O+CO2↑;
(5)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(6)亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,即5FeSO4•7H2O~KMnO4,根据消耗0.1000mol•L-1 KMnO4溶液20.00mL,所以晶体中FeSO4•7H2O的质量分数=$\frac{0.1000mol/L×0.02L×5×278g/mol}{ag}$×100%=$\frac{13.9}{a}$,
故答案为:$\frac{13.9}{a}$.
点评 本题是一道金属元素的单质以及化合物性质的综合应用题目,考查学生分析和解决问题的能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 分液 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
| A. | Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 | |
| B. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 | |
| C. | 与相同浓度的酸反应的速率:Na2CO3<NaHCO3 | |
| D. | Na着火时可用泡沫灭火器灭火 |
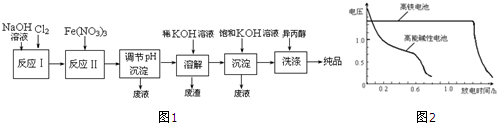
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为:
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为: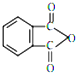 +2CH3CH2CH2CH2OH→
+2CH3CH2CH2CH2OH→ +H2O
+H2O +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$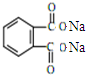 +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.