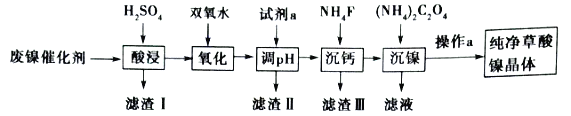
题目内容
【题目】氮及其化合物在科学研究和化工生产等领域都有着广泛的应用。请回答下列问题:
(1)与氮元素同族的第四周期元素的基态原子价层电子轨道表达式为___________。
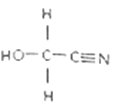
(2)HOCH2CN的结构简式如图,该分子中σ键与π键数目之比为___________,其分子中碳原子的杂化方式为___________,该物质中除氢以外的元素的第一电离能由大到小的顺序为______________________。
(3)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为___________(任写一种)。NH3的 VSEPR模型为___________。[Cu(NH3)4]2+的结构可用示意图表示为______________________。
(4)①已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
2UF4·NH4F+3NH3↑+4H2O↑,NH4HF2中不含有的作用力为___________(填选项字母)。
A.共价键 B.配位键 C.金属键 D.离子键 E.氢键
②NH3和H2O的键角由大到小的顺序为______________________(用分子式表示),原因是_______________________________________________________。
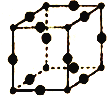
(5)Cu3N的晶胞结构如图所示,N3-的配位数为___________,Cu+半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为___________g/cm3(列出计算式即可,阿伏加德罗常数的值用NA表示)。
【答案】![]() 3:1 sp、sp3 N>O>C CCl4 、 SiCl4 、 CBr4 、 SiF4 等合理答案即可 四面体形
3:1 sp、sp3 N>O>C CCl4 、 SiCl4 、 CBr4 、 SiF4 等合理答案即可 四面体形 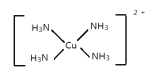 或
或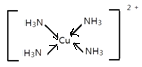 C NH3>H2O NH3分子中N原子采用sp3杂化,N原子还有一对孤对电子,而H2O分子中的O原子采用sp3杂化,O原子有两对孤对电子,据电子对互斥理论,H2O中的两对孤电子对对成键电子对的斥力更大,所以H2O的键角更小。或者答:孤电子对对孤电子对的斥力大于孤电子对对成键电子对的斥力。 6
C NH3>H2O NH3分子中N原子采用sp3杂化,N原子还有一对孤对电子,而H2O分子中的O原子采用sp3杂化,O原子有两对孤对电子,据电子对互斥理论,H2O中的两对孤电子对对成键电子对的斥力更大,所以H2O的键角更小。或者答:孤电子对对孤电子对的斥力大于孤电子对对成键电子对的斥力。 6 ![]()
【解析】
(1)氮元素的价层电子2s22p3,与氮元素同族的第四周期元素的基态原子价层电子4s24p3,写出价层电子轨道表达式;
(2)HOCH2CN分子中σ键为6个、π键数为2;其分子中碳原子的杂化方式有2种,形成4个σ键的碳是sp3杂化,形成2个σ键,2个π键的碳为sp杂化;N原子价电子构型是半充满状态,在同一周期第一电离能会变大。
(3)与SO42-互为等电子体的分子的化学式为CCl4 、SiCl4 、CBr4 、SiF4 等。
NH3中N原子孤电子对数=(5-3)/2=1,价层电子对数=3+1=4。
[Cu(NH3)4]2+的中Cu与N形成4个配位键。
(4)①NH4HF2中含有的作用力:N-H共价键 ,N-H中有一个是配位键 ,铵根离子和酸根离子间是离子键,H和F之间可形成氢键。
②NH3和H2O的键角由大到小的顺序为NH3>H2O, NH3分子中N原子采用sp3杂化,N原子还有一对孤对电子,而H2O分子中的O原子采用sp3杂化,O原子有两对孤对电子,据电子对互斥理论,H2O中的两对孤电子对对成键电子对的斥力更大,所以H2O的键角更小。或者答:孤电子对对孤电子对的斥力大于孤电子对对成键电子对的斥力。
(5)由Cu3N的晶胞结构如图,大球个数=12×1/4=3,小球个数=1/8=1,所以大球表示Cu原子、小球表示N原子,由空间结构可知,中间面上N的周围有4个Cu,上下面上各有1个Cu,则N3-的配位数4+2=6,Cu3N的密度=m/V,以此来解答.
(1)氮元素的价层电子2s22p3,与氮元素同族的第四周期元素的基态原子价层电子4s24p3,基态原子价层电子轨道表达式为![]() ;
;
(2)HOCH2CN分子中σ键为6个、π键数为2,σ键与π键数目之比为3:1;其分子中碳原子的杂化方式有2种,形成4个σ键的碳是sp3杂化,形成2个σ键,2个π键的碳为sp杂化;N原子价电子构型是半充满状态,在同一周期第一电离能会变大,该物质中除氢以外的元素的第一电离能由大到小的顺序为N>O>C。
(3)与SO42-互为等电子体的分子的化学式为CCl4 、SiCl4 、CBr4 、SiF4 等。
NH3中N原子孤电子对数=(5-3)/2=1,价层电子对数=3+1=4,NH3的 VSEPR模型为四面体形;[Cu(NH3)4]2+的结构可用示意图表示为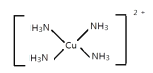 或
或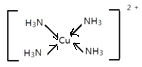 ;
;
(4)①NH4HF2中含有的作用力:N-H共价键 ,N-H中有一个是配位键 ,铵根离子和酸根离子间是离子键,H和F之间可形成氢键,无金属键,故选C。
②NH3和H2O的键角由大到小的顺序为NH3>H2O, NH3分子中N原子采用sp3杂化,N原子还有一对孤对电子,而H2O分子中的O原子采用sp3杂化,O原子有两对孤对电子,据电子对互斥理论,H2O中的两对孤电子对对成键电子对的斥力更大,所以H2O的键角更小。或者答:孤电子对对孤电子对的斥力大于孤电子对对成键电子对的斥力。
(5)由Cu3N的晶胞结构如图,大球个数=12×1/4=3,小球个数=1/8=1,所以大球表示Cu原子、小球表示N原子,由晶胞结构可知,N位于晶胞的顶点,每个顶点周围最近且距离相等的Cu有6个,则N3-的配位数为6;
晶胞的体积=[(2a+2b)×10-10cm]3,Cu3N的密度=m/V=![]() g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。

【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
【题目】(1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=___________kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________(用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________,O2的转化率为___________(用百分数表示,且保留小数点后一位),该反应的平衡常数为___________(列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________

(3)下列有关该反应的说法正确的是___________(填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)