题目内容
12.草木灰的主要成分是K2CO3,它与盐酸反应的化学方程式为K2CO3+2HCl═2KCl+H2O+CO2↑,又知CO2能被澄清石灰水吸收,为了探究草木灰和盐酸反应前后物质的总质量是否相等,某学生借用了下列试剂与仪器(如图所示)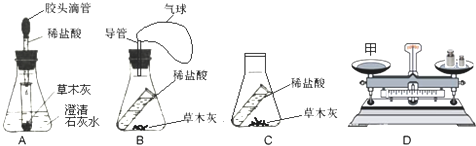
(1)在实验装置D中,为保证两次称量所得质量相等,甲处应放置的实验装置是A(填序号)
(2)实验的具体步骤:第一步,天平调零,第二步,称量反应前A装置的质量,第三步挤压A的胶头滴管,让盐酸和草木灰反应
第四步,称量反应后A装置的质量,第五步,观察反应前后质量是否相等.
(3)若选取了另两套装置,则反应前左盘的质量大于反应后左盘的质量,理由分别是B装置反应后,气球胀大,浮力增大;C装置不密闭,生成的气体逸出容器..
分析 (1)跟据质量守恒定律可知参加反应的各物质质量总和等于生成的各物质质量总和,因此根据草木灰与盐酸反应的特点会生成二氧化碳选择密闭系统实验较为合适.
(2)具体的步骤可根据探究的要求,对反应前及反应后物质的质量总和进行测量即可.
(3)根据K2CO3+2HCl═2KCl+H2O+CO2↑的特点会生成二氧化碳,该装置不密封进行分析判断即可.
解答 解:(1)该实验的目的是探究草木灰与盐酸反应前后物质的总质量是否相等,而该反应生成的二氧化碳容易扩散到空气中导致测量的结果不准确,所以应选择密闭的装置进行实验,在ABC三装置中A是密封装置,二氧化碳不会扩散到空气中,而是被石灰水吸收,装置反应前后测量的质量相等相等,B装置密封生成气体后会是该装置浮力增大,而C装置则是敞口的装置,生成的二氧化碳会扩散到空气中测量的质量不会相等,故答案为:A;
(2)根据实验的要求,实验的主要步骤应该是:测量反应前装置A的质量(含反应物),让A中的盐酸和草木灰接触反应,再测量反应后A装置的质量,从而判断其质量的关系,故答案为:A;挤压A的胶头滴管,让盐酸与草木灰反应;A;
(3)选取BC装置进行实验时,由于B装置反应后,气球胀大,浮力增大,C不密封生成的二氧化碳会扩散到空气中,导致剩余产物的质量比反应物质量要小,因此该装置不适合验证质量守恒定律,故答案为:大于;B装置反应后,气球胀大,浮力增大;C装置不密闭,生成的气体逸出容器.
点评 本题是对于质量守恒定律定律的理解与运用,在考虑物质的质量总和时,要把参加反应的气体或者生成的气体也得考虑到,该题以实验探究题考查质量守恒定律的探究,解答时要注意反应物或生成物中的气体物质,结果的偏大或偏小往往是气体物质造出的.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
2.关于金属的腐蚀和防护的叙述中,正确的是( )
| A. | 金属被腐蚀的本质是M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 对某些工具的“机械转动部位”选用刷油漆的方法来防锈 | |
| C. | 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 | |
| D. | 常温下,置于空气中的金属主要发生化学腐蚀 |
3.对下列常见现象进行分析,其中发生了化学变化的是( )
| A. | 煮饭前米用水洗一洗 | B. | 冰箱中放入木炭后,异味消失 | ||
| C. | 自行车轮胎在烈日下爆裂 | D. | 食物变质 |
20.西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁.经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4,则R的化学式为( )
| A. | FeS | B. | Fe2S3 | C. | FeS2 | D. | FeO |
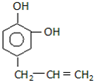
17.下列表示的是丙基的是( )
| A. | CH3 CH2CH3 | B. | CH3 CH2CH2- | C. | -CH2CH2CH2- | D. | (CH3 )2CH- |
4.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,待到水的质量跟液态芳香烃X的质量相等,则X的分子式是( )
| A. | C10H14 | B. | C11H16 | C. | C12H18 | D. | C13H20 |
1.下列关于△H-T△S说法中正确的是( )
| A. | △H<0、△S<0的反应在任何温度下都可以自发进行 | |
| B. | 蔗糖溶于水及气体扩散过程均是熵减过程 | |
| C. | △H-T△S只用于判断温度、压强一定的反应能否自发进行 | |
| D. | △H-T△S<0的反应,在该条件下一定剧烈反应 |
 B.
B.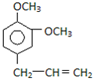 C.
C.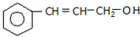
 .
.