题目内容
【题目】I.常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者_____(填“>”“<”或“=”)。
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)__ V(乙) (填“>”“<”或“=”)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO3— B.CO32— C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
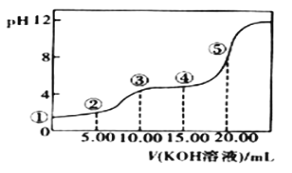
(1)点③所示溶液中所有离子的浓度由大到小的顺序为:_____________________。
(2)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
【答案】< A 向右 减小 < B HClO+CO32- = ClO-+HCO3- c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH-) 0.1
【解析】
I.醋酸是弱酸,0.1mol·L-1醋酸溶液中pH>1,因此pH=1的醋酸溶液中c(CH3COOH)比前者大,因此与足量锌发生反应,后者产生氢气的量多于前者;
II.(1)醋酸中存在CH3COOH![]() CH3COO-+H+,加水稀释促进电离,A、加水稀释,促进电离,但c(H+)降低,故A符合题意;
CH3COO-+H+,加水稀释促进电离,A、加水稀释,促进电离,但c(H+)降低,故A符合题意;
B、同一种溶液中,物质的量浓度之比等于其物质的量之比,加水稀释促进电离,H+的物质的量增大,CH3COOH的物质的量减少,因此该比值增大,故B不符合题意;
C、c(H+)×c(OH-)=Kw,Kw只受温度的影响,加水稀释,水的离子积不变,故C不符合题意;
D、加水稀释,c(H+)减小,根据水的离子积不变,则c(OH-)增大,因此该比值增大,故D不符合题意;
(2)醋酸为弱酸,加水稀释,促进电离,即CH3COOH的电离平衡向右移动;醋酸中加入无水CH3COONa,c(CH3COO-)增大,抑制醋酸的电离,c(H+)减小,c(CH3COOH)增大,即该比值减小;
(3)醋酸为弱酸,相同pH时,c(CH3COOH)>c(HCl),等体积两种酸,消耗等浓度的NaOH,消耗氢氧化钠的体积关系:V(甲)<V(乙);
(4)根据电离平衡常数,推出电离出H+能力大小顺序:CH3COOH>H2CO3>HClO>HCO3-,根据越弱越水解的规律,结合H+能力最强的是CO32-,故B正确;根据电离平衡常数,以及电离出H+能力的强弱顺序,该离子反应为HClO+CO32-=HCO3-+ClO-;
III.(1)点③加入10mLKOH,溶质为KHC2O4,此时溶液显酸性,说明HC2O4-的电离程度大于其水解,c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)点④加入15mLKOH,溶质为KHC2O4和K2C2O4,此时溶液的体积为25mL,c(K+)=0.1×15/25mol·L-1=0.06mol·L-1,根据物料守恒,c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1×10/25mol·L-1=0.04mol·L-1,因此有c(K+)+c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol·L-1。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案
