题目内容
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
【答案】D
【解析】H2C2O4与KMnO4反应的化学方程式为:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,设样品中草酸晶体的质量分数为x,滴定所用KMnO4溶液为100xmL,则[m(样品)x![]() 126g/mol
126g/mol![]() ]:(0.100
]:(0.100![]() 100x
100x![]() 1000)mol=5:2,解得m(样品)=12.6g,答案选D。
1000)mol=5:2,解得m(样品)=12.6g,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
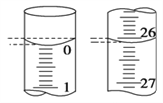
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
【题目】已知CO是工业上重要的原料,可作燃料、冶炼金属、合成液体酒精等。
(1)研究表明:反应CO(g)+H2O(g) ![]() H2(g)+CO2(g) ⊿H = ?
H2(g)+CO2(g) ⊿H = ?
平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
Ⅰ.通过平衡常数随温度的变化情况,推断反应热⊿H________ 0 (填>、<、﹦ )
Ⅱ.若反应在500℃时进行,设起始的CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为________。
(2)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D 均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①甲中通入CO的电极为______(填“正”、“负”、“阴”、“阳”)极,该电极反应方程式为__________。
②若乙中A极析出的气体在标准状况下的体积为2.24L,此时要使乙中CuSO4溶液恢复到原来的浓度,需要加入的物质及其物质的量是(___________)。
A.0.1molCuO B.0.1molCu(OH)2 C.0.1molCu2(OH)2CO3
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示。完成丙装置C、D电极反应式:C:____________________________;D:________________________________;丙装置溶液中 c(Cl-)= _______________ mol/L 。