题目内容
2.下列化合物,阳离子与阴离子半径之比最小的是( )| A. | KF | B. | NaBr | C. | LiI | D. | KCl |
分析 同主族元素,阴、阳离子半径随着原子序数的增大而增大,要使阳离子与阴离子的半径之比最小,阳离子半径最小,阴离子半径最大即可.
解答 解:同主族元素,阴、阳离子半径随着原子序数的增大而增大,要使阳离子与阴离子的半径之比最小,阳离子半径最小,阴离子半径最大即可,所以阳离子半径最小的是锂离子,阴离子半径最大的是碘离子,故选C.
点评 本题考查了微粒半径大小的比较,难度不大,注意电子层结构相同的离子半径大小的比较方法.

练习册系列答案
相关题目
12.高中阶段我们相继学习了同位素、同素异形体、同分异构体、同系物的概念,下列有关这四个概念说法不正确的是( )
| A. | 因为C2H6与C3H8互称同系物,所以C4H8与C6H12一定互称同系物 | |
| B. | 氕、氘、氚互称同位素 | |
| C. | O2与O3、红磷与白磷、金刚石与石墨互称同素异形体 | |
| D. | 邻二甲苯、间二甲苯、对二甲苯互称同分异构体 |
10.一定温度下,反应 N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容,充入He | D. | 恒压,充入He |
17.下列叙述中正确的是( )
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜是负极 | |
| C. | 铜铁原电池工作时,若有2.8 g铁被溶解,电路中就有0.15mol电子通过 | |
| D. | 由镁、铝作电极与NaOH溶液构成的原电池中铝是负极 |
11.a b c d四个集气瓶中装有Cl2 H2 HCl HBr的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现红棕色液滴,则a b c d瓶气体是( )
| A. | Cl2 HBr HCl H2 | B. | Cl2 HCl HBr H2 | C. | H2HBr HCl Cl2 | D. | H2 HCl HBr Cl2 |
13.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、K+、Br-、SCN- | B. | NH4+、Na+、CO32-、OH- | ||
| C. | K+、Na+、PO43-NO3- | D. | Al3+、Mg2+、SO42-HCO3- |
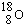
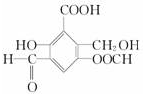 取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.
取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.
 →
→ ,.
,. .
.