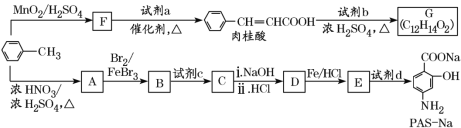
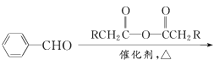
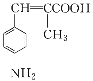
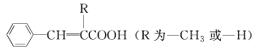题目内容
【题目】下列实验方案能达到实验目的的是
A | B | C | D | |
实验方案 |
置于光亮处 |
|
|
|
实验目的 | 验证甲烷与氯气发生化学反应 | 中和热的测定 | 验证乙炔的还原性 | 验证铁钉发生析氢腐蚀 |
A.AB.BC.CD.D
【答案】A
【解析】
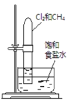
A.甲烷与Cl2发生取代反应,生成HCl和多种氯代物,可观察到试管中有白雾和油状液体生成,试管内液面上升,证明甲烷与氯气发生取代反应,故A正确;
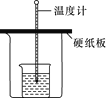
B.中和热的测定实验的关键是保温,应在大烧杯和小烧杯之间加入碎纸片以防止热量散失,同时要使用环形玻璃搅拌棒使溶液混合均匀,故B错误;
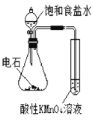
C.电石与饱和食盐水反应生成的乙炔中混有硫化氢等杂质,硫化氢也能使酸性高锰酸钾溶液褪色,影响乙炔的还原性的验证,故C错误;
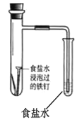
D.食盐水为中性溶液,铁钉发生吸氧腐蚀,酸性环境下才发生析氢腐蚀,故D错误;
综上所述答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
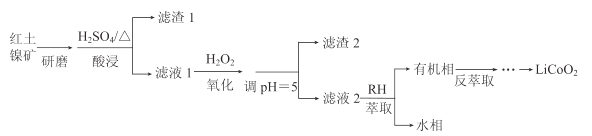
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
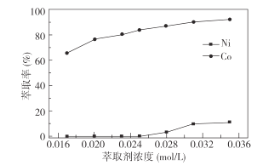
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%