题目内容
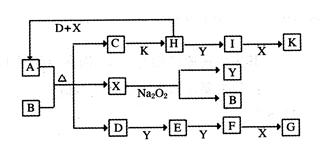
(10分) A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
的单质是生活中常见的金属,相关物质间的关系如下图所示。
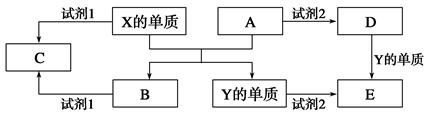
(1)X的单质与A反应的化学方程式是______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是________________________________________
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_______________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________________________________。
的单质是生活中常见的金属,相关物质间的关系如下图所示。

(1)X的单质与A反应的化学方程式是______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是________________________________________
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_______________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________________________________。
(1)Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
(2)2Al+2H2O+2OH-===2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+
②Al3++3H2O ?Al(OH)3+3H+
?Al(OH)3+3H+
③2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑(3分)
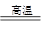 Al2O3+2Fe
Al2O3+2Fe(2)2Al+2H2O+2OH-===2AlO+3H2↑
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+
②Al3++3H2O
 ?Al(OH)3+3H+
?Al(OH)3+3H+③2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑(3分)
(1)元素X、Y的单质是生活中常见的金属,且X能置换出Y,则X是铝,Y是铁。则A是氧化铁,Y是氧化铝。所以X的单质与A反应的化学方程式是Fe2O3+2Al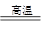 Al2O3+2Fe。
Al2O3+2Fe。
(2)铝能与氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2H2O+2OH-===2AlO+3H2↑。
(3)①若试剂1和试剂2均是稀硫酸,则D是氯化铁。检验铁离子的试剂是KSCN溶液,因此方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+。
②铝离子在水溶液中水解生成氢氧化铝和氢离子,从而溶液显酸性,方程式是Al3++3H2O ?Al(OH)3+3H+。
?Al(OH)3+3H+。
③根据反应物和生成物可知,反应的方程式是2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑。
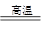 Al2O3+2Fe。
Al2O3+2Fe。(2)铝能与氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的方程式是2Al+2H2O+2OH-===2AlO+3H2↑。
(3)①若试剂1和试剂2均是稀硫酸,则D是氯化铁。检验铁离子的试剂是KSCN溶液,因此方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,证明原溶液中含有Fe3+。
②铝离子在水溶液中水解生成氢氧化铝和氢离子,从而溶液显酸性,方程式是Al3++3H2O
 ?Al(OH)3+3H+。
?Al(OH)3+3H+。③根据反应物和生成物可知,反应的方程式是2FeSO4+2NaNO2+H2SO4===2Fe(OH)SO4+Na2SO4+2NO↑。

练习册系列答案
相关题目
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。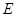 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.