题目内容
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。回答下列问题:
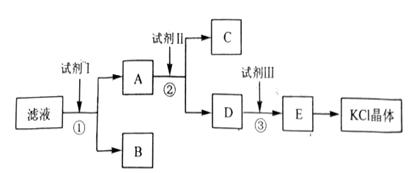
(1)起始滤液的pH 7(填“大于”、“小于”或“等于”),其原因是(用方程式表达)
(2)试剂I的化学式为 ,
(3)③中发生反应的化学方程式为 ;

(1)起始滤液的pH 7(填“大于”、“小于”或“等于”),其原因是(用方程式表达)
(2)试剂I的化学式为 ,
(3)③中发生反应的化学方程式为 ;
大于 碳酸根离子水解呈碱性 CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
BaCl2 ,2HCl+K2CO3=2KCl+H2O+CO2↑
 HCO3-+OH-。
HCO3-+OH-。BaCl2 ,2HCl+K2CO3=2KCl+H2O+CO2↑
(1)滤液中含有碳酸钾,碳酸钾水解显碱性,方程式为CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
(2)除去硫酸钾和碳酸钾需要氯化钡,所以试剂I时氯化钡;但过量的氯化钡需要碳酸钾来除去,所以试剂Ⅱ是碳酸钾。而过量的碳酸钾则需要盐酸除去,即试剂Ⅲ是盐酸,反应的方程式为2HCl+K2CO3=2KCl+H2O+CO2↑。
 HCO3-+OH-。
HCO3-+OH-。(2)除去硫酸钾和碳酸钾需要氯化钡,所以试剂I时氯化钡;但过量的氯化钡需要碳酸钾来除去,所以试剂Ⅱ是碳酸钾。而过量的碳酸钾则需要盐酸除去,即试剂Ⅲ是盐酸,反应的方程式为2HCl+K2CO3=2KCl+H2O+CO2↑。

练习册系列答案
相关题目