题目内容
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由:______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
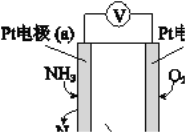
① 电极b上发生的是______反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________。
【答案】K= ![]() 逆向 减小 温度 L2﹥L1,其他条件相同时,增大压强有利于平衡向气体体积缩小的方向移动,从而提高H2(g)的平衡转化率 。 还原 2NH3-6e-+6OH- = N2+6H2O
逆向 减小 温度 L2﹥L1,其他条件相同时,增大压强有利于平衡向气体体积缩小的方向移动,从而提高H2(g)的平衡转化率 。 还原 2NH3-6e-+6OH- = N2+6H2O
【解析】
(1)根据平衡常数表达式
(1)① N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 1 3 0
转化浓度(mol/L) 0.4 1.2 0.8
平衡浓度(mol/L) 0.6 1.8 0.8
因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式为K=c2(NH3)/c(N2)c3(H2)=0.82/(1.82×0.6),故答案为:K=0.82/(1.82×0.6)。
2NH3(g)的平衡常数表达式为K=c2(NH3)/c(N2)c3(H2)=0.82/(1.82×0.6),故答案为:K=0.82/(1.82×0.6)。
②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应,起始时反应进行的方向为逆向,故答案为:逆向。
③由题可知,合成氨为放热反应,所以升高温度平衡向逆反应方向移动,所以反应的化学平衡常数变小,故答案为:减小。
(2)i.由图可知,X越大,氢气转化率越低,升高温度平衡向逆反应方向移动,则氢气转化率减小,则X表示温度,故答案为:温度。
ii.由N2(g)+3H2(g)2NH3(g)△H<0,温度高,氢气转化率小,压强大,平衡正向移动,氢气转化率大,图中等温度时L2对应的氢气转化率大,则压强L1<L2,故答案为:L1<L2;其他条件相同时,增大压强有利于平衡向气体体积缩小的方向移动,从而提高H2(g)的平衡转化率。
(3)①Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原发生还原反应,故答案为:还原。
②因为a极为负极,负极是氨气发生氧化反应变成氮气,且OH﹣向a极移动参与反应,故电极反应式为2NH3﹣6e﹣+6OH﹣=N2+6H2O,故答案为:2NH3﹣6e﹣+6OH﹣=N2+6H2O。

 名校课堂系列答案
名校课堂系列答案













