��Ŀ����
����Ŀ����ҵ�����Ȼ�隣������̿��Ʊ��ߴ�̼���̵�������ͼ��ʾ��

��֪�������̿����Ҫ�ɷ���MnCO3�����к�Fe��Ca��Mg��Al��Ԫ�ء�
��Al3����Fe3��������ȫ��pH�ֱ�Ϊ4.7��3.2��Mn2����Mg2����ʼ������pH�ֱ�Ϊ8.1��9.1��
�۱��չ�������Ҫ��ӦΪMnCO3��2NH4Cl ![]() MnCl2��2NH3����CO2����H2O��
MnCl2��2NH3����CO2����H2O��
(1)���ͼ1��2��3���������չ�������ѵı����¶ȡ�����ʱ�䡢m(NH4Cl)/m(���̿��)�ֱ�Ϊ____________��____________��____________��

(2)�Խ���Һ��������ʱ�����ȼ���MnO2��Fe2��ת��ΪFe3�����ٵ�����ҺpH�ķ�Χ__����Fe3����Al3����Ϊ��������ȥ��Ȼ�����NH4F��Ca2����Mg2����Ϊ�����������ȥ��
(3)��̼���ᾧ�������У�����̼�����ʱ��Ӧ�����ӷ���ʽΪ____��
(4)���������п�ѭ��ʹ�õ�������________��
(5)���õζ����ⶨ����Һ��Mn2���ĺ�����ʵ�鲽�裺��ȡ1.000 g�����������м����Թ�������������ᣬ����ʹ��Ӧ2Mn2����NO3-��4PO43-��2H��![]() 2[Mn(PO4)2]3����NO2-��H2O��ֽ��в���ȥ�������������Թ���������泥�������ӦNO2-��NH4+===N2����2H2O�Գ�ȥNO2-������ϡ�����ữ����2.00 mol��L��110.00 mL��������隣���Һ���еζ��������ķ�ӦΪ[Mn(PO4)2]3����Fe2��===Mn2����Fe3����2PO43-����0.10 mol��L��110.00 mL����K2Cr2O7��Һǡ�ó�ȥ������Fe2����
2[Mn(PO4)2]3����NO2-��H2O��ֽ��в���ȥ�������������Թ���������泥�������ӦNO2-��NH4+===N2����2H2O�Գ�ȥNO2-������ϡ�����ữ����2.00 mol��L��110.00 mL��������隣���Һ���еζ��������ķ�ӦΪ[Mn(PO4)2]3����Fe2��===Mn2����Fe3����2PO43-����0.10 mol��L��110.00 mL����K2Cr2O7��Һǡ�ó�ȥ������Fe2����
������K2Cr2O7��Һ��Fe2����Ӧ(��ԭ������Cr3��)�����ӷ���ʽΪ___________��
���������̵���������Ϊ________��
���𰸡�500 �� 60 min 1.10 4.7��pH<8.1 Mn2����2HCO3-===MnCO3����CO2����H2O NH4Cl 6Fe2����Cr2O72-��14H��===6Fe3����2Cr3����7H2O 77%
��������
(1)����ͼ������������¶���500 �����ϡ�����ʱ����60 min���ϡ�![]() ��1.1���ϣ��̽����ʳ���90% ��
��1.1���ϣ��̽����ʳ���90% ��
(2)�������ӵ�Ŀ���ǽ�Fe3����Al3����Ϊ������ȥ�����ұ�֤Mn2�����ܳ�����
(3)��̼���ᾧ�������У�̼������������ӷ�Ӧ����̼���̳����Ͷ�����̼���壻
(4)��������ͼ������ѭ��ʹ�õ����ʣ�
(5) �ٸ��ݵ�ʧ�����غ���д����K2Cr2O7��Һ��Fe2����Ӧ�����ӷ���ʽ��
�ڸ��ݹ�ϵʽMn2����[Mn(PO4)2]3����Fe2�������̵�����������
(1)����ͼ������������¶���500 �����ϡ�����ʱ����60 min���ϡ�![]() ��1.1���ϣ��̽����ʳ���90% �����Ա��չ�������ѵı����¶ȡ�����ʱ�䡢
��1.1���ϣ��̽����ʳ���90% �����Ա��չ�������ѵı����¶ȡ�����ʱ�䡢![]() �ֱ�Ϊ500 �桢60 min�� 1.10��
�ֱ�Ϊ500 �桢60 min�� 1.10��
(2)�������ӵ�Ŀ���ǽ�Fe3����Al3����Ϊ������ȥ�����ұ�֤Mn2�����ܳ��������Ե�����ҺpH�ķ�ΧΪ4.7��pH<8.1��
(3)��̼���ᾧ�������У�̼������������ӷ�Ӧ����̼���̳����Ͷ�����̼���壬��Ӧ���ӷ���ʽ��Mn2����2HCO3-===MnCO3����CO2����H2O��
(4)��������ͼ����ѭ��ʹ�õ�������NH4Cl��
(5) �ٸ��ݵ�ʧ�����غ㣬����K2Cr2O7��Һ��Fe2����Ӧ�����ӷ���ʽ��6Fe2����Cr2O72-��14H��===6Fe3����2Cr3����7H2O��
��Cr2O72-�����ʵ�����0.10 mol��L��1��0.01L=0.001mol����Ӧ6Fe2����Cr2O72-��14H��===6Fe3����2Cr3����7H2O����Fe2�������ʵ�����0.006mol�� [Mn(PO4)2]3����Fe2��===Mn2����Fe3����2PO43-����Fe2�������ʵ�����2.00 mol��L��1��0.01L��0.006mol=0.014mol������Mn2����[Mn(PO4)2]3����Fe2������֪Mn2�������ʵ�����0.014mol���̵���������Ϊ![]() ��
��

 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��N2(g)��3H2(g)![]() 2NH3(g) ��H=-92.2kJ/mol
2NH3(g) ��H=-92.2kJ/mol
��1���ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0 mol/L | 3.0 mol /L | 0 |
Ͷ�Ϣ� | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
�ٰ�Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��״̬ʱH2��ת����Ϊ40%������¶��ºϳɰ���Ӧ��ƽ�ⳣ������ʽΪ_____________��
�ڰ�Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________�������������
���������¶ȣ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��________����������С�����䡱����
��2��L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ���ϳɰ���Ӧ��H2(g)��ƽ��ת������X�ı仯��ϵ��

�� X��������������______��
�� �ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______��
��3���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���£�

�� �缫b�Ϸ�������______��Ӧ�����������ԭ����
�� д���缫a�ĵ缫��Ӧʽ��_________��
����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��N2(g)��3H2(g)![]() 2NH3(g) ��H=-92.2kJ/mol
2NH3(g) ��H=-92.2kJ/mol
��1���ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0 mol/L | 3.0 mol /L | 0 |
Ͷ�Ϣ� | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
�ٰ�Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��״̬ʱH2��ת����Ϊ40%������¶��ºϳɰ���Ӧ��ƽ�ⳣ������ʽΪ_____________��
�ڰ�Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________�������������
���������¶ȣ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��________����������С�����䡱����
��2��L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ���ϳɰ���Ӧ��H2(g)��ƽ��ת������X�ı仯��ϵ��

�� X��������������______��
�� �ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______��
��3���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���£�
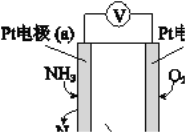
�� �缫b�Ϸ�������______��Ӧ�����������ԭ����
�� д���缫a�ĵ缫��Ӧʽ��_________��


