题目内容
19.下列关于Cl-和Cl2的说法中,正确的是( )| A. | Cl-和Cl2均有毒 | B. | Cl-和Cl2均呈黄绿色 | ||
| C. | 相比较,Cl-稳定,Cl2活泼 | D. | Cl-和Cl2均能与金属单质反应 |
分析 Cl-的最外层电子数为8,则性质稳定,且离子在水中为无色;而Cl2为黄绿色气体,有毒,具有强氧化性,性质活泼,以此来解答.
解答 解:A、因Cl-无毒,而Cl2有毒,故A错误;
B、Cl-为无色,而Cl2为黄绿色,故B错误;
C、因结构决定性质,Cl-和Cl2结构不同,则性质不同,故C正确;
D、Cl-不能与金属单质反应,而Cl2能与金属单质反应,故D错误;
故选C.
点评 本题考查氯气和氯离子的性质,熟悉它们的结构和性质的关系是解答的关键,并熟悉常见气体和离子的性质来解答.

练习册系列答案
相关题目
7.能正确表示下列化学反的离子方程式是( )
| A. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| B. | 碳酸镁溶于硝酸中:2H++CO32-═CO2↑+H2O | |
| C. | 在澄清的石灰水中通入少量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 饱和氯化铁溶液滴入沸水中:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ |
14.下列说法中正确的是( )
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
20.目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下两组数据:
①实验2条件下平衡时H2O 体积分数为20%;
②下列方法中可以证明上述已达平衡状态的是ae;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化 c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化 e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表,则反应CO(g)+H2O(g)?CO2(g)+H2(g),在900K时,该反应平衡常数的对数值(lgK)=0.36.
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(4)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是0.01mol/L.
(5)25℃时,在20mL0.1mol/L醋酸中加入V mL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.

A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)<c(Na+)=0.1mol/L
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
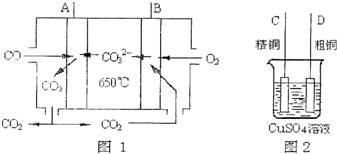
①写出A极发生的电极反应式CO-2e-+CO32-=2CO2 ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与D极(填“C”或“D”)相连.
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②下列方法中可以证明上述已达平衡状态的是ae;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化 c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化 e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表,则反应CO(g)+H2O(g)?CO2(g)+H2(g),在900K时,该反应平衡常数的对数值(lgK)=0.36.
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
请写出CO除SO2的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
(4)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是0.01mol/L.
(5)25℃时,在20mL0.1mol/L醋酸中加入V mL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.

A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO-)<c(Na+)=0.1mol/L
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式CO-2e-+CO32-=2CO2 ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与D极(填“C”或“D”)相连.
1.苯基跟-C3H7相连而成的烃的一溴代物共有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 11种 |
 .
.