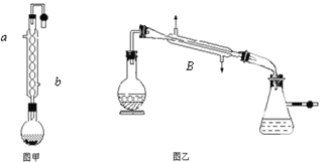
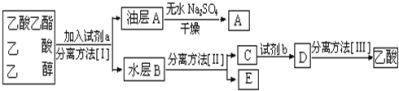
题目内容
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
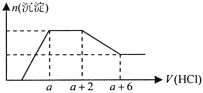
A.原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
B.反应最后形成的溶液中的溶质为NaCl
C.原溶液中一定含有Na2SO4
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
【答案】A
【解析】
结构图象曲线变化可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含氢氧根离子,则与氢氧根离子不能共存的离子为Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2-与HCO3-发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3-;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有钠离子,以此解答该题。
由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH-离子,则与氢氧根离子不能共存的离子为Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2-、SiO32-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2-与HCO3-发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3-;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;
A.依据判断原溶液中一定含有的阴离子是:OH-、SiO32-、AlO2-、CO32-,故A正确;
B.反应最后形成的溶液中的溶质为NaCl和AlCl3,故B错误;
C.溶液中硫酸根离子不能确定,剩余原溶液不一定含有Na2SO4,故C错误;
D.依据图象可知和碳酸根离子反应的盐酸为2体积,CO32-+2H+=CO2↑+H2O 氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3+3H+=Al3++3H2O,原溶液中含有CO32-与AlO2-的物质的量之比为3:4,故D错误;
故答案为A。

【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序______(填字母)。

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和____________。
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________________________________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:______________________。