��Ŀ����
����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ��:
��1��ȡ����������250 mL 0.4 mol��L��1�Ĵ�����Һ����0.4 mol��L��1�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ�����������Һ��Ũ�Ƚ��б궨���ش��������⣺
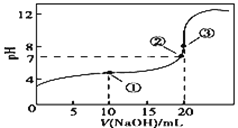
�ٽ�һ�������ı������ˮϡ�����У���Һ�ĵ��������仯����ͼ��ʾ����ϡ��������Һ��pH�ɴ�С��˳��______������ĸ����

������250 mL 0.4 mol��L��1 ������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�������������ͷ�ιܺ�____________��
��Ϊ�궨�ô�����Һ��ȷŨ�ȣ���0.2000 mol��L��1��NaOH��Һ��20.00 mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�����(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
�ô�����Һ��ȷŨ��Ϊ_____________������С�������λ���������궨�����У���ɲⶨ���ƫ�ߵ�ԭ�������_______________����ѡ����ѡ���÷֣���
a��δ�ñ�Һ��ϴ��ʽ�ζ���
b���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
c��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
d���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
��2����С��ͬѧ̽��Ũ�ȶԴ������̶ȵ�Ӱ��ʱ����pH�Ʋⶨ25��ʱ��ͬŨ�ȵĴ����pH���������£�
����Ũ��( mol��L��1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
�ٸ��ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵�������______________________________________________________________��
�ڼ�����pH��ֽ�� 0.1mol��L��1 ������ҺpH�ķ���___________��
������ˮ���������ʵ��֤����������Ա�̼���ǿ��______________________��
���𰸡� a��c��b 250mL����ƿ 0.2000 mol/L ad 0.0100 mol/L �����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��l ������ȡһСƬpH��ֽ���ڱ������ϣ��ò�����պȡ��������Һ������ֽ�ϣ������ɫ������ �ֱ�ⶨ��Ũ��CH3COONa��NaHCO3��Һ��pH��NaHCO3��Һ��pH�ϴ����������Ա�̼���ǿ
����������1���ٵ�������Խǿ������Ũ��Խ��������Ũ��Խ��pHԽС����a��b��c������Һ��pH�ɴ�С��˳��Ϊa��c��b���ڸ�����������;ѡȡ����������250 mL 0.4 mol��L��1 ������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�������������ͷ�ιܺ�250 mL����ƿ���۸���NaOH���������3��������Ȼ���ϴ���ȥ��������������NaOHƽ�����Ϊ20 mL��
������������Һƽ��Ũ��=![]() =0.2000 mol/L��a��δ�ñ�Һ��ϴ��ʽ�ζ��ܣ������ı�Һ��������ӣ��ⶨ���ƫ�ߣ�b���ζ��յ����ʱ�����ӵζ��̶ܿȣ�����������ȷ���������ĵı�Һ�������ƫС������c�����⣩=
=0.2000 mol/L��a��δ�ñ�Һ��ϴ��ʽ�ζ��ܣ������ı�Һ��������ӣ��ⶨ���ƫ�ߣ�b���ζ��յ����ʱ�����ӵζ��̶ܿȣ�����������ȷ���������ĵı�Һ�������ƫС������c�����⣩= ��֪���ⶨ���ƫ�ͣ�c��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ���˲�����ȷ����Ӱ��ⶨ�����d���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ������c�����⣩=
��֪���ⶨ���ƫ�ͣ�c��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ���˲�����ȷ����Ӱ��ⶨ�����d���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ������c�����⣩= ��֪��
��֪�� ![]() ƫ�ߣ���ⶨ���Ũ��ƫ�ߣ���ѡad����2����������Ϊǿ�ᣬ����ȫ����������һԪ�ᣬ0.0100mol/L�Ĵ����pHӦΪ2����֪pHΪ3.38��˵������û����ȫ����,������ʽ��۵������ǣ�0.0100 mol/L �����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��l������pH��ֽ�� 0.1mol��L��1 ������ҺpH�ķ���: ������ȡһСƬpH��ֽ���ڱ������ϣ��ò�����պȡ��������Һ������ֽ�ϣ������ɫ�����գ��۸�������ˮ����ɣ�����ε������Ӧ����Խ�������ε�ˮ��̶�Խ�����ʵ���Ũ����ͬʱ����Һ�ļ���Խǿ��pHԽ�����ʵ��֤����������Ա�̼���ǿ���ֱ�ⶨ��Ũ��CH3COONa��NaHCO3��Һ��pH��NaHCO3��Һ��pH�ϴ����������Ա�̼���ǿ��
ƫ�ߣ���ⶨ���Ũ��ƫ�ߣ���ѡad����2����������Ϊǿ�ᣬ����ȫ����������һԪ�ᣬ0.0100mol/L�Ĵ����pHӦΪ2����֪pHΪ3.38��˵������û����ȫ����,������ʽ��۵������ǣ�0.0100 mol/L �����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��l������pH��ֽ�� 0.1mol��L��1 ������ҺpH�ķ���: ������ȡһСƬpH��ֽ���ڱ������ϣ��ò�����պȡ��������Һ������ֽ�ϣ������ɫ�����գ��۸�������ˮ����ɣ�����ε������Ӧ����Խ�������ε�ˮ��̶�Խ�����ʵ���Ũ����ͬʱ����Һ�ļ���Խǿ��pHԽ�����ʵ��֤����������Ա�̼���ǿ���ֱ�ⶨ��Ũ��CH3COONa��NaHCO3��Һ��pH��NaHCO3��Һ��pH�ϴ����������Ա�̼���ǿ��

����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺
�� | ��A | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
��1���ܡ��ݡ���ԭ�Ӱ뾶�ɴ�С��˳���� ��
��2���ڡ��ۡ��ߵ���ۺ������������ǿ������˳���� ��
��3���١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ�� ��
��4���ɱ�������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� �� a��MnO2������ b��FeCl3������ c��Na2SO3������ d��KMnO4 ��