题目内容
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
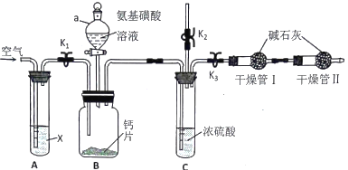
(1)仪器a的名称为____________________。
(2)A装置内X是___________________溶液(填化学式),B 装置内发生反应的化学方程式为____________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间,关闭K1、K2,打开K3,打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是___________________________。干燥管Ⅱ的作用_________________________。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为____________________________。
【答案】分液漏斗 NaOH CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑ 将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率 吸收空气中的CO2和H2O ![]() ×100%
×100%
【解析】
根据实验目的要测样品中钙的质量分数,找到![]() CaCO3
CaCO3![]() CO2 关系,围绕碱石灰增重的量进行求解。因为空气中含有CO2,所以要排净空气的CO2干扰。
CO2 关系,围绕碱石灰增重的量进行求解。因为空气中含有CO2,所以要排净空气的CO2干扰。
(1)根据装置图可知仪器a的名称为分液漏斗;答案:分液漏斗。
(2)本实验目的是测定碳酸钙型补钙剂中钙的含量,是通过测定磺酸(H2NSO3H)与碳酸钙反应生成CO2的量来完成,所以要先排净装置中的空气,防止空气中的CO2气体造成误差,所以A装置内X应为NaOH 溶液,除去空气中的CO2,B装置内是磺酸(H2NSO3H)与碳酸钙反应生成CO2和磺酸钙,发生反应的化学方程式为CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑;答案:NaOH;CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑。
(3)第二次通入空气目的是将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率;答案:将装置内CO2排至干燥管Ⅰ中,提高CO2吸收率;
(4)测得干燥管在实验前后重量分别为m1g和m2g,即二氧化碳的质量分数为(m2-m1)g,二氧化碳的物质的量为![]() mol,根据方程式CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑,计算出碳酸钙的物质的量为
mol,根据方程式CaCO3+2H2NSO3H=Ca( H2NSO3)2+H2O+CO2 ↑,计算出碳酸钙的物质的量为![]() mol,根据CaCO3
mol,根据CaCO3![]() ,所以钙的质量为:
,所以钙的质量为:![]() mol
mol ![]() g/mol=
g/mol= ![]() g;所以钙的质量分数为=
g;所以钙的质量分数为=![]() ×100%;答案:
×100%;答案:![]() ×100%。
×100%。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
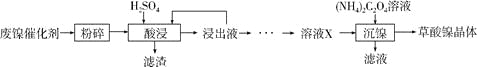
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
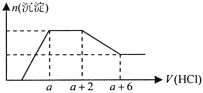
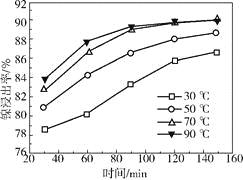
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。