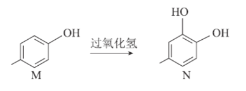
题目内容
【题目】来源于电镀、冶金等行业的含六价铬(含Cr2O72-或CrO42-)废水具有很强的生物毒性,因此,含铬废水必须严格控制六价铬的质量浓度,达标后才能允许排放。一种处理含铬酸性废水的工艺如图所示:
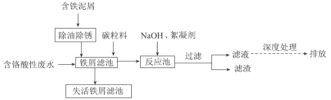
回答下列问题:
(1)去除铁屑表面油污的方法是__。
(2)酸性环境中,废水中主要存在大量Cr2O72-和少量CrO42-,原因是__(用化学用语和文字表述解释)。
(3)向“铁屑滤池"中加入碳粒料的作用是__;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为__。
(4)向“反应池"中加入NaOH使Cr3+沉淀,池中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
Cr3+(aq)+3OH-(aq)。已知:某离子浓度小于等于10-5mol·L-1时视为完全沉淀;常温下,Ksp[Cr(OH)3]=10-32。常温下,欲使废水中Cr3+完全沉淀,则溶液的pH至少应为__。
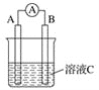
(5)①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,画出电解池的装置示意图并标出电极和电解质溶液的名称___(可选电极:Fe和石墨)。

②上述装置中,阳极的电极反应式为__。
【答案】将铁屑放入纯碱溶液中搅拌 2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72 形成原电池,加快反应速率 6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O 5
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72 形成原电池,加快反应速率 6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O 5  Fe – 2e- = Fe2+
Fe – 2e- = Fe2+
【解析】
⑴常用纯碱除掉油污,纯碱溶液显碱性。
⑵酸性环境中,发生反应2CrO42 +2 H+ ![]() H2O + Cr2O72,利用平衡移动进行分析。
H2O + Cr2O72,利用平衡移动进行分析。
⑶向“铁屑滤池"中加入碳粒料主要分析原电池原理,“铁屑滤池”中存在的Fe2+与Cr2O72反应生成Cr3+和Fe3+。
⑷利用溶度积常数进行计算氢氧根浓度,再计算氢离子浓度,再计算pH。
⑸①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,铁变为亚铁离子,因此铁作阳极,石墨作阴极,生成的亚铁离子和重铬酸根反应,因此电解液为重铬酸钾;②阳极铁失去电子变为Fe2+。
⑴常用纯碱除掉油污,纯碱溶液显碱性,油污再碱性条件下水解而除掉,因此去除铁屑表面油污的方法是将铁屑放入纯碱溶液中搅拌、过滤;故答案为:将铁屑放入纯碱溶液中搅拌。
⑵酸性环境中,废水中主要存在大量Cr2O72和少量CrO42,原因是2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72;故答案为:2CrO42 +2 H+
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72;故答案为:2CrO42 +2 H+ ![]() H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72。
H2O + Cr2O72,酸性环境,平衡正向移动,生成Cr2O72。
⑶向“铁屑滤池"中加入碳粒料的作用是形成原电池,加快反应速率;“铁屑滤池”中存在的Fe2+可将Cr2O72-还原,该反应的离子方程式为6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O;故答案为:形成原电池,加快反应速率;6Fe2+ + Cr2O72 + 14 H+ = 6Fe3+ + 2Cr3+ + 7H2O。
⑷常温下,Ksp[Cr(OH)3]=1032。常温下,欲使废水中Cr3+完全沉淀,![]() ,
,![]() ,
,![]() ,则溶液的pH至少应为5;故答案为:5。
,则溶液的pH至少应为5;故答案为:5。
⑸①参照上述工艺流程知,也可采用电解原理处理含铬酸性废水,铁变为亚铁离子,因此铁作阳极,石墨作阴极,生成的亚铁离子和重铬酸根反应,因此电解液为重铬酸钾,电解池的装置示意图并标出电极和电解质溶液的名称 ;故答案为:
;故答案为: 。
。
②上述装置中,阳极的电极反应式为Fe – 2e- = Fe2+;故答案为:Fe – 2e- = Fe2+。

【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D