��Ŀ����
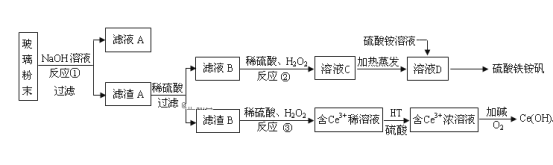
����Ŀ���Ͼ���ʾ�������к�SiO2��Fe2O3��CeO2��FeO�����ʡ�ij����С���Դ˲�����ĩΪԭ�ϣ��Ƶ�Ce(OH)4��������立���Fe2(SO4) 3��(NH4) 2SO4��24H2O�ݣ�����������£�
��֪�������������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��Ce4+�н�ǿ�����ԣ�
��CeO2������ϡ���ᣬҲ������NaOH��Һ��
�ش��������⣺
��1������A����Ҫ�ɷ���___��
��2����Ӧ����H2O2��������___��
��3����Ӧ�۵����ӷ���ʽ��___��
��4����֪�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+(ˮ��)+6HT(�л���)![]() 2CeT3 (�л��㣩+ 6H+(ˮ��)����ƽ��ǶȽ��ͣ���CeT3(�л��㣩����H2SO4 ��ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ����___��
2CeT3 (�л��㣩+ 6H+(ˮ��)����ƽ��ǶȽ��ͣ���CeT3(�л��㣩����H2SO4 ��ýϴ��ĺ�Ce3+��ˮ��Һ��ԭ����___��
��5��������立���Fe2(SO4) 3��(NH4) 2SO4��24H2O�ݹ㷺����ˮ�ľ����������侻ˮԭ�������ӷ���ʽ������___��
���𰸡�Fe2O3��CeO2��FeO ����ʹFe2+ת��ΪFe3+ 2GeO2+6H+ +H2O2 = 2Ge3++4H2O+O2�� ���Һ�м���H2SO4ʹc(H+)����ƽ�����γ�Ge3+ˮ��Һ�����ƶ� Fe3++3H2O![]() Fe(OH)3 +3H+
Fe(OH)3 +3H+
��������
�ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A(Fe2O3��CeO2��FeO)��ϡ�������˵���ҺB������������Һ��������������������������������ҺC��Ϊ�������������������������ⲻ���������ʣ����������õ���ҺDΪ������������Һ������Һ�м����������Һ�õ�������立�������B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2������HT������ȡ����Ce3+��ˮ��Һ����ȡ������Ce3+�Ӽ����������������ԭ��Ӧ����Ce(OH)4���Դ˽����⡣
(1)�Ͼ���ʾ�������к�SiO2��Fe2O3��CeO2��FeO�����ʣ�����NaOH��Һ�ɳ�ȥ���еĶ������裬������A����Ҫ�ɷ���Fe2O3��CeO2��FeO��
(2)��Ӧ����H2O2������������ʹFe2+ת��ΪFe3+��
(3)��Ӧ����������Һ��CeO2���������ԭ����Ce3+���ӣ��������ⱻ����������������Ӧ�����ӷ���ʽ2GeO2+6H++H2O2=2Ge3++4H2O+O2����
(4)�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+(ˮ��)+6HT(�л���)�T2CeT3(�л���)+6H+(ˮ��)��������������������Ũ�ȣ�ƽ������������γ�Ge3+ˮ��Һ�����ƶ�����ýϴ��ĺ�Ce3+��ˮ��Һ��
(5)������立�[Fe2(SO4)3(NH4)2SO424H2O]�㷺����ˮ�ľ����������侻ˮԭ�����ܽ����Һ�е�������ˮ�����������������壬������������������ʵ����ã����Ծ�ˮ����Ӧ�����ӷ���ʽΪ��Fe3++3H2O![]() Fe(OH)3+3H+��
Fe(OH)3+3H+��

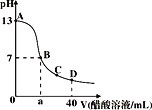
����Ŀ����1L��0.01molNaAlO2��0.02molNaOH����Һ�л���ͨ�������̼����n(CO2)�����Ⱥ���������ͬ�ķ�Ӧ����0.01mol<n(CO2) ![]() 0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
0.015ʱ�����ķ�Ӧ�ǣ�2 NaAlO2+ CO2+2H2O=2Al(OH)3��+Na2CO3���ж�Ӧ��ϵ��ȷ����( )
ѡ�� | n(CO2)/mol | ��Һ�����ӵ����ʵ���Ũ�� |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D