题目内容
将4 mol A气体和2 mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 | A.用物质A表示的反应的平均速率为0.3 mol?L-1?s-1 |
| B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% |
| D.2s时物质B的浓度为0.7 mol?L-1 |
B
考查可逆反应的有关计算,2A(g)+B(g)  2C(g)
2C(g)
起始浓度(mol/l) 2 1 0
变化的浓度(mol/L) 0.6 0.3 0.6
平衡浓度(mol/L) 1.4 0.7 0.6
所以物质A的反应速率是0.6mol/÷2s=0.3mol?L-1?s-1.
2s时的压强是起始时的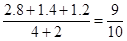
所以B不正确,其余都是正确的,答案选B、
 2C(g)
2C(g)起始浓度(mol/l) 2 1 0
变化的浓度(mol/L) 0.6 0.3 0.6
平衡浓度(mol/L) 1.4 0.7 0.6
所以物质A的反应速率是0.6mol/÷2s=0.3mol?L-1?s-1.
2s时的压强是起始时的
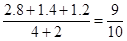
所以B不正确,其余都是正确的,答案选B、

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
 CO(g)+H2(g), CO(g)+H2O(g)
CO(g)+H2(g), CO(g)+H2O(g)  2NH3达到平衡时( )
2NH3达到平衡时( ) HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅
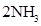 ,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施
,ΔH<0 为使氨的产率提高,理论上应采取低温高压的措施 2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
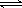 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是( )  2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为( )
2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为( ) CO2(g)+H2 (g)
CO2(g)+H2 (g)