题目内容
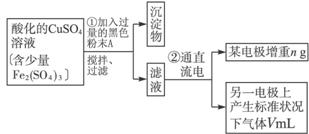
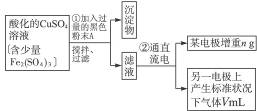
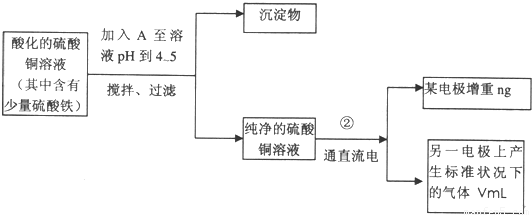
已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+完全水解,转化为Fe(OH)3。(即在pH≤5的环境中Cu2+不沉淀,而在pH≥4的环境中,Fe3+全部沉淀)某同学欲提纯含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液,并利用电解纯净的CuSO4溶液得到的数据,计算Cu的相对原子质量。
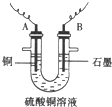
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。A的化学式为______________,加入A的作用是_________________________________________。
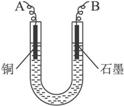
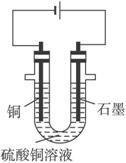
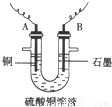
(2)将较纯净的CuSO4溶液放入右图所示的装置中进行电解,石墨电极上的电极反应式为_______________,总的电解反应的离子方程式为___________
________________。
(3)实验完成后,石墨电极产生的气体在标准状况下的体积为VmL,铜电极增重ag,则Cu的相对原子质量为__________。(用带有a、V的计算式表示)

(1)CuO;调节溶液的pH至4~5,除去Fe3+ ;
(2)4OH--4e-=O2↑+2H2O;2Cu2++2H2O
 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;(3)
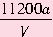 ;
;【试题分析】

练习册系列答案
相关题目