题目内容
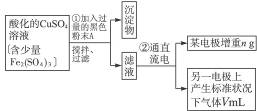
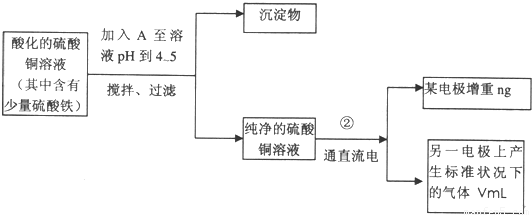
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下: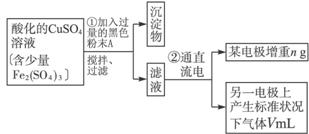
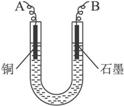
图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
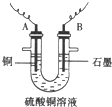
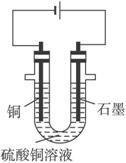
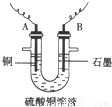
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
A.称量电解前电极的质量
B.电解后电极在烘干、称量前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
解析:2Cu2++2H2O![]() 2Cu+4H++O2↑。
2Cu+4H++O2↑。
n(Cu)∶n(O2)=2∶1,n(Cu)=![]() mol,n(O2)=
mol,n(O2)=![]()
![]()
![]()
答案:(1)CuO 消耗H+使溶液的pH升高,Fe3+水解生成Fe(OH)3沉淀 (2)负
(3)在B极有无色无味气体生成,在A极有红色物质生成,电解质溶液的蓝色变浅
2Cu2++2H2O![]() 2Cu+4H++O2↑ (4)ABDE C (5)
2Cu+4H++O2↑ (4)ABDE C (5)![]()

练习册系列答案
相关题目