题目内容
【题目】在一密闭容器中,反应3A(g)+B(s)![]() 2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C. 增加A的浓度,平衡向正方向移动,平衡常数增大
D. 增加B的用量,正、逆反应速率不变,平衡不移动
【答案】D
【解析】
A、B物质是固体,反应后气体系数和增大,增大压强,平衡逆向移动,故A错误;
B、升高温度,正、逆反应速率均增大;正反应吸热,升高温度平衡向正方向移动,故B错误;
C、平衡常数只与温度有关,增加A的浓度,平衡向正方向移动,平衡常数不变,故C错误;
D、 B物质是固体,增加B的用量,浓度不变,所以正、逆反应速率不变,平衡不移动,故D正确;
本题答案选D。

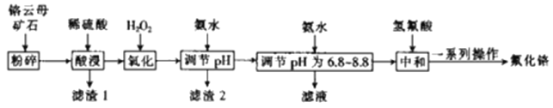
【题目】如图为碳元素的价类二维图,结合图中的物质部分转化关系,完成下列问题:
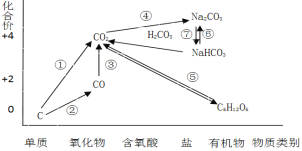
(1)下列说法正确的是 __________
a.要实现反应①一定要与氧化剂作用
b.要实现反应②一定要与还原剂作用
c.在一定条件下木炭与浓硝酸能实现 反应①转化
d.反应⑤属于非氧化还原反应
(2)下列有关碳及其化合物类别及性质说法不正确的是__________
a.CO不属于酸性氧化物,具有还原性
b.CO2属于酸性氧化物,可以与碱反应生成碳酸盐
c.NaHCO3属于弱酸的酸式盐,既能与硫酸反应又能与NaOH反应
d.金刚石和石墨互为同素异形体,其物理性质和化学性质均相同
(3)高炉炼铁的过程是将铁矿石(Fe2O3)还原成金属铁的过程,实现了反应③的转化,请写出其反应的化学方程式,并用“双线桥”表示电子的得失情况______________________________ 。
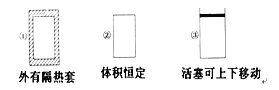
(4)化学活动课上,两组同学分别用如图所示甲、乙两装置探究“Na2CO3、NaHCO3与稀盐酸的反应”。按下表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。请回答:
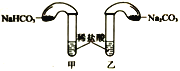
①两组反应开始时,装置___________(填“甲”或“乙”)中的气球体积先变大,该装置中反应的离子方程式是______________________。
②当试管中不再有气体生成时,两组实验出现不同现象。
试剂用量 | 实验现象 | 分析原因 | |
第A组 | 0.84gNaHCO3 1.06gNa2CO3 6ml 4mol·L-1盐酸 | 甲中气球与乙中气球的 体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V(CO2)甲=V(CO2)乙 |
第B组 | 1.2gNaHCO3 1.2gNa2CO3 6ml 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
|
按上表第A组原因分析方法,分析第B组实验甲中气球为比乙中气球体积大的原因__________。用离子方程式表示第B组乙中气球又缩小的原因:______________。