题目内容
18.如图的装置为实验室模拟铜的精练.以下叙述正确的是( )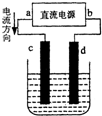
| A. | c为纯铜,d为粗铜 | |
| B. | 实验前,铜片可用热碱溶液除油渍,盐酸除铜绿 | |
| C. | 用含Cu2+的盐配成电解质溶液,电解后其浓度保持不变 | |
| D. | 若阴极得到2摩尔电子,则阳极质量减少64克 |
分析 A、根据电流方向判断a为正极,b为负极;
B、油渍能和碱发生水解反应,且温度越高,除去油污能力越强,铜绿为碱式碳酸铜,能和酸反应生成盐和水;
C、根据溶液中的离子判断;
D、根据阳极反应判断.
解答 解:A、由电流方向判断a为正极,b为负极,所以c为阳极是粗铜,d为阴极是纯铜,故A错误;
B、油渍能和碱发生水解反应,且温度越高,除去油污能力越强,铜绿为碱式碳酸铜,能和酸反应生成盐和水,所以盐酸能除去铜绿,故B正确;
C、电解精炼铜的过程中,硫酸铜溶液的浓度会逐渐减小,故C错误;
D、阳极反应首先是比铜活泼的金属失电子,所以阴极得到2摩尔电子,则阳极质量减少不是64克,故D错误.
故选B.
点评 关于电解精炼铜的有关知识:
1、电解精炼铜的过程中,硫酸铜溶液的浓度会逐渐减小;
2、粗铜中往往含有锌、铁、镍、银、金等多种杂质,当含杂质的铜在阳极不断溶解时,位于金属活动性顺序中铜以前的金属,会优先失去电子变成离子,但是它们的阳离子比铜离子难还原,所以它们并不在阴极上获得电子析出,而是留在电解质溶液里.而位于金属活动性顺序中铜之后的银、金等杂质,因为失去电子的能力比铜弱,不能在阳极上失去电子变成阳离子溶解在溶液中,而是以单质的形式沉积在电解槽底,形成阳极泥.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.水中加入下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | NH4NO3溶液 | C. | KAl(SO4)2 溶液 | D. | NaCl溶液 |
6.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氨水 | 氯水 | 硫酸 | 醋酸 | 干 冰 |
| B | 氧化铁 | 盐酸 | 硫酸钡 | 亚 硫酸 | 二氧化硫 |
| C | 胆矾 | 碘酒 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 氯化氢 | 氢氧化钠溶液 | 氯化钠 | 磷酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
10.下列离子反应方程式书写正确的是( )
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | |
| C. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ | |
| D. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-=Al2S3↓ |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: