题目内容
13.某温度下,合成氨的反应N2(g)+3H2(g)?2NH3(g)中,各物质的平衡浓度分别是:c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,求:(1)该反应的平衡常数;
(2)N2、H2的初始浓度;
(3)H2的转化率.
分析 (1)根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
(2)根据氨气浓度计算氮气、氢气浓度变化量,起始浓度=平衡浓度+浓度变化量;
(3)氢气转化率=$\frac{氢气浓度变化量}{氢气起始浓度}$×100%.
解答 解:(1)平衡浓度分别是:c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,则平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{{4}^{2}}{3×{9}^{3}}$=7.32×10-3,
答:平衡常数为7.32×10-3.
(2)根据N2(g)+3H2(g)?2NH3(g),可知△c(N2)=$\frac{1}{2}$△c(NH3)=2mol/L,△c(H2)=$\frac{3}{2}$△c(NH3)=6mol/L,故N2的初始浓度=3mol/L+2mol/L=5mol/L,H2的初始浓度=9mol/L+6mol/L=15mol/L,
答:N2的初始浓度为5mol/L,H2的初始浓度为15mol/L;
(3)氢气转化率=$\frac{6mol/L}{15mol/L}$×100%=40%,
答:氢气转化率为40%.
点评 本题考查化学平衡计算、平衡常数计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
3.下列对各物质性质的解释不正确的是
( )
| 选项 | 性质 | 原因 |
| A | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | 重金属盐中毒可服用牛奶解毒 | 牛奶中蛋白质变性,保护了人体的蛋白质 |
| D | 明矾用来净水 | Al3+水解生成Al(OH)3胶体,具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法中正确的是( )
| A. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下△H不相同 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 任何放热反应在常温下都能发生 | |
| D. | 化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得 |
8.下列离子方程式书写正确的是( )
| A. | 醋酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铁与稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+2Ag+═2Ag+Cu2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
18.如图的装置为实验室模拟铜的精练.以下叙述正确的是( )
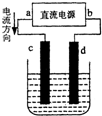

| A. | c为纯铜,d为粗铜 | |
| B. | 实验前,铜片可用热碱溶液除油渍,盐酸除铜绿 | |
| C. | 用含Cu2+的盐配成电解质溶液,电解后其浓度保持不变 | |
| D. | 若阴极得到2摩尔电子,则阳极质量减少64克 |
2.铜液吸收CO的反应是放热反应,其化学方程式为:Cu(NH3)2Ac+CO+NH3═[Cu(NH3)3CO]Ac,如果要提高上述反应的反应速率,可以采取的措施是( )
| A. | 减压 | B. | 增加NH3的浓度 | C. | 升温 | D. | 及时移走产物 |
