题目内容
8.将0.1mol/L的氢氧化钠溶液20mL与0.2mol/L的盐酸30mL混合后,所得溶液的pH是多少?分析 0.1mol/L的氢氧化钠溶液20mL中含有的氢氧化钠的物质的量n=CV=0.1mol/L×0.02L=0.002mol,30mL0.2mol/L盐酸溶液中HCl的物质的量n=CV=0.2mol/L×0.03L=0.006mol,两者混合后盐酸过量,溶液中C(H+)=$\frac{{n}_{({H}^{+})}-{n}_{(O{H}^{-})}}{{V}_{溶液}}$,据此计算溶液的pH=-lgC(H+).
解答 解:0.1mol/L的氢氧化钠溶液20mL中含有的氢氧化钠的物质的量n=CV=0.1mol/L×0.02L=0.002mol,30mL0.2mol/L盐酸溶液中HCl的物质的量n=CV=0.2mol/L×0.03L=0.006mol,两者混合后盐酸过量,溶液中C(H+)=$\frac{{n}_{({H}^{+})}-{n}_{(O{H}^{-})}}{{V}_{溶液}}$=$\frac{0.006mol-0.002mol}{0.05L}$=0.08mol/L,故溶液的pH=-lgC(H+)=-lg0.08=2-lg8=2-0.9=1.1.
答:溶液的pH为1.1.
点评 本题考查了酸碱混合后溶液pH的计算,注意酸碱混合后,若酸过量,溶液显酸性,则求混合后溶液中的氢离子的浓度,若混合后显碱性,则求氢氧根的浓度.

练习册系列答案
相关题目
18.如图的装置为实验室模拟铜的精练.以下叙述正确的是( )
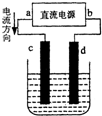

| A. | c为纯铜,d为粗铜 | |
| B. | 实验前,铜片可用热碱溶液除油渍,盐酸除铜绿 | |
| C. | 用含Cu2+的盐配成电解质溶液,电解后其浓度保持不变 | |
| D. | 若阴极得到2摩尔电子,则阳极质量减少64克 |
13.下列化学方程式中.对电子转移情况分析不正确的是( )
| A. | 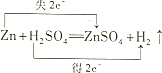 | B. |  | ||
| C. | 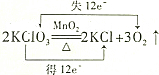 | D. |  |
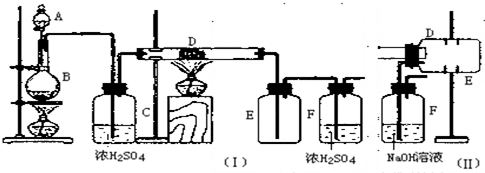
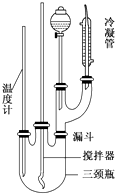
3. 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如下表:
若实验时1-溴异戊烷的产率为40%,则可制取1-溴异戊烷15.1g.
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如下表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |

 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: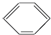 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0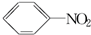 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$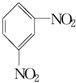 +H2O
+H2O