题目内容
20.有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A与气态物质EB4;E的M层电子数是K层电子数的2倍.(1)写出这五种元素的名称:A氧,B氟,C氢,D钠,E硅.
(2)EB4的空间构型是正四面体形 E原子是sp3杂化.
分析 E的M层电子数是K层电子数的2倍,K层容纳2个电子,M层有4个电子,则E为Si元素.
A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物,则为H2O和H2O2、Na2O和Na2O2;
CB可与EA2反应生成C2A和气态物质EB4;则C为H元素,A为O元素,D为Na元素;
CB可与EA2反应生成C2A和气态物质EB4;该反应为4HF+SiO2═2H2O+SiF4↑,则B为F元素.
然后利用元素及其单质、化合物的性质来解答.
解答 解:E的M层电子数是K层电子数的2倍,K层容纳2个电子,M层有4个电子,则E为Si元素.
A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物,则为H2O和H2O2、Na2O和Na2O2;
CB可与EA2反应生成C2A和气态物质EB4;则C为H元素,A为O元素,D为Na元素;
CB可与EA2反应生成C2A和气态物质EB4;该反应为4HF+SiO2═2H2O+SiF4↑,则B为F元素.
所以A为O元素,C为H元素,B为F元素,D为Na元素,E为Si元素.
(1)由以上分析可知A为氧,B为氟,C为氢,D为钠,E为硅,故答案为:氧; 氟; 氢; 钠; 硅;
(2)SiF4中Si形成4个δ键,没有孤对电子,为sp3杂化,正四面体形结构,故答案为:正四面体形;sp3.
点评 本题考查原子结构、元素周期律、元素的性质,熟悉元素形成的常见化合物是解答本题的关键,侧重原子结构与性质及化学用语的考查,注意杂化理论的应用,题目难度中等.

练习册系列答案
相关题目
8.下列有关化学用语表示正确的是( )
| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: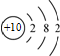 | D. | 乙酸的分子式:C2H4O2 |
15.下列说法正确的是( )
①需要加热方能发生的反应一定是吸收能量的反应
②释放能量的反应在常温下一定很容易发生
③反应是释放能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④释放能量的反应加热到一定温度引发后,停止加热反应也能继续进行.
①需要加热方能发生的反应一定是吸收能量的反应
②释放能量的反应在常温下一定很容易发生
③反应是释放能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小
④释放能量的反应加热到一定温度引发后,停止加热反应也能继续进行.
| A. | 只有③④ | B. | 只有①② | C. | ①②③④ | D. | 只有②③④ |
5.下列各指定微粒的数目比不是1:1的是( )
| A. | NaHSO4晶体中阳离子和阴离子 | B. | Na2O2晶体中阴离子和阳离子 | ||
| C. | Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
12.由两种原子组成的纯净物( )
| A. | 一定是化合物 | B. | 可能是单质,可能是化合物 | ||
| C. | 一定是单质 | D. | 一定是不同的单质 |
9.下列金属材料在使用过程中采取的防腐蚀措施错误的是( )
| A. | 自行车的钢圈镀铬 | B. | 室外的铁制水管外面刷油漆 | ||
| C. | 电线外面包上一层塑料 | D. | 地下钢管连接铜块防腐 |
 ,X与W组成的化合物中存在共价键(填“离子”“共价”).
,X与W组成的化合物中存在共价键(填“离子”“共价”).