��Ŀ����
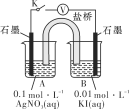
����Ŀ�������������������ܺ����Ա��㷺Ӧ�������ࡢ���ӡ������ȹ�ҵ���϶�ӰҺ������Ҫ��Na3Ag(S2O3)2��ʽ���ڣ�ʵ�����÷϶�ӰҺ�Ʊ�Ag�ľ���������ͼ��ʾ��
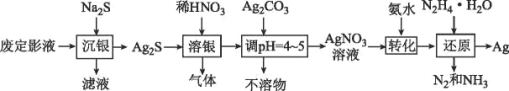
ע������ԭ��ʱ����Ag+ֱ����N2H4H2O��Ӧ���ڼ��ң����Բ��ü��백ˮ��ʹAg+�백�γ�[Ag(NH3)2]+������Ag+��Ũ�ȣ��Ӷ���Ӧ����Ag+������������ʹ��Ӧ�ܹ�ƽ�Ƚ��С�
�ش��������⣺
��1����������ʱ������������___(�ѧʽ����
��2��N2H4H2O(ˮ���£�Ϊ��ɫ������״����Һ�壬����ǿ��ԭ�ԣ�ʵ�����Ʊ�ԭ��ΪNaClO+2NH3=N2H4H2O+NaCl�������õ���ʵ��װ����ͼ��ʾ��
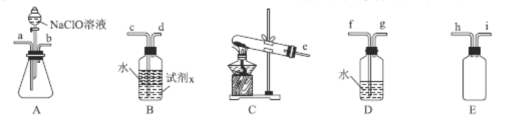
�ٱ�ʵ�����ò�����װ����___��(����ĸ�����Լ�x��___(�ѧʽ����дһ�֣���
�ڼ���NaClO��ҺʱҪ�����μӣ�Ŀ����___��
�۰����������ҵķ�������װ�õ�����˳��Ϊ___(�������ӿ�Сд��ĸ����
��3��AgNO3����������ֽ⡣������������AgNO3��Һ����Ũ���ɻ��AgNO3���壬ʵ��װ����ͼ��ʾ��
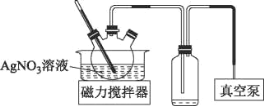
��ʹ����ձõ�Ŀ����___��
�ڲⶨAgNO3����Ĵ���(���ʲ����뷴Ӧ����ȡ2.00g�Ʊ���AgNO3���壬��ˮ�ܽ⣬���ݵ�100mL��ȷ��ȡ25.00mL��Һ���ữ����뼸��NH4Fe(SO4)2��Һ��ָʾ��������0.1000molL-1NH4SCN����Һ�ζ�������NH4SCN����Һ��ƽ�����Ϊ29.00mL���������AgNO3����������Ϊ___��
���𰸡�NO D CCl4 ˮ���»�ԭ�Ժ�ǿ����ֹNaClOŨ�ȹ��������� ehi(ih)abc(d) ʹ��ϵ�γɸ�ѹ��������ˮ���ڽϵ͵��¶���������ͬʱ��ֹAgNO3�ֽ� 98.6%
��������
(1)��������ͼ����������������Ag2S�м���ϡ���ᣬ����������ԭ��Ӧ�Ƕȷ�����
(2)�������Ʊ�N2H4H2O�ķ�Ӧ��֪����Ҫ�Ʊ���������ϵװ��ͼ����ϰ�����N2H4H2O���������ѡ��ʵ��װ�ý��з�����������������ˮ��
��N2H4H2O����ǿ��ԭ�ԣ�NaClO���������ԣ�
�����(2)�ķ���������������
(3)����������ṩ��Ϣ��AgNO3����������ֽ���з�����
��NH4SCN����Һ��ƽ�����Ϊ29.00mL����NH4SCN�����ʵ���Ϊ0.1000molL-1��0.029L=2.9��10-3mol������Ag++SCN-=AgSCN�������������������������ȷ������������
(1)��������ͼ����������������Ag2S�м���ϡ���ᣬAg2S�е���Ϊ-2�ۣ�������ͼ�̬�����л�ԭ�ԣ�������������ԣ����߷���������ԭ��Ӧ��Ag2S�е��ϼ�����ת��Ϊ���ʣ�ϡ������������ԭΪNO�����������������в���������ΪNO��
(2)�ٸ����Ʊ�N2H4H2O�ķ�ӦNaClO+2NH3=N2H4H2O+NaCl��֪����Ҫ�Ʊ�������ʵ�������Ȼ�狀��������ƹ��������ȡ��������Ӧѡ��װ��C������װ��A�з�Һ©���е�ҩƷΪNaClO����Aװ��Ϊ��ȡˮ���µ�װ�ã�װ��E��ȫƿ���ã�������������ˮ������ʹ��װ��D��Ҫʹ��װ��B����������β��ͬʱ��ֹ����������Bװ����Һ��ֲ㣬��ˮ���ϲ㣬x�Լ����²㣬˵��x�Լ��ܶȱ�ˮ����ˮ�����ܣ������ܽⰱ���������ѧ֪ʶ����x�Լ���ΪCCl4�ȣ�
��N2H4H2O����ǿ��ԭ�ԣ�NaClO���������ԣ���NaClO��Һ������쵼�¹������ɽ���Ӧ���ɵ�N2H4H2O�������������μ�NaClO��Һ�ܷ�ֹ���ɵ�N2H4H2O��������
�۽�Ϣ��еķ���������������ҵķ���װ�õ�����˳��Ϊehi(ih)abc(d)��
(3)�ٸ�������ṩ��Ϣ��AgNO3����������ֽ⣬ʵ��װ������ձÿ����γɸ�ѹ��������ˮ���ڽϵ͵��¶���������ͬʱ��ֹAgNO3�ֽ⣻
��NH4SCN����Һ��ƽ�����Ϊ29.00mL����NH4SCN�����ʵ���Ϊ0.1000molL1��0.029L=2.9��103mol�����������غ㣬��Ϸ�ӦAg++SCN=AgSCN����֪��������������Ϊ2.9��103mol��170g/mol��![]() =1.972g����������������������Ϊ
=1.972g����������������������Ϊ![]() ��100%=98.60%��
��100%=98.60%��

 ��У����ϵ�д�
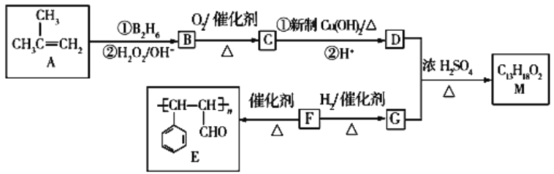
��У����ϵ�д�����Ŀ����Ȳ��������ϩ��ҵ�е���Ҫ���Ʒ�Ӧ��������һ��Ӧ���Խ���ϩ��Ʒ�е���Ȳ�������ͣ��Ա��������ϩ�ۺϴ������ж�����ҵ�ϳ�Ϊ̼��������̡�
��֪��I. ![]()
![]() ��
��
II. ![]()
![]() ��
��
�ش��������⣺
(1)��֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� |
|
|
|
|
����/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() ��
��
(2)400Kʱ�����ܱ������н������ʵ�����![]() ��
��![]() ��ϣ������ʵ��Ĵ������з�Ӧ������
��ϣ������ʵ��Ĵ������з�Ӧ������![]() ���ﵽƽ��ʱ���
���ﵽƽ��ʱ���![]() ����ƽ��ʱ
����ƽ��ʱ![]() _____
_____![]() ��
��
(3)��ǰ���о�������Ȳ��![]() �Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������
�Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������![]() �����ϵ�������*��ע��
�����ϵ�������*��ע��

�Ʋ���ϩ��![]() �����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______
�����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______![]() ���ò���Ļ�ѧ����ʽΪ___________��
���ò���Ļ�ѧ����ʽΪ___________��
(4)![]() ʱ���������Ϊ1:2��
ʱ���������Ϊ1:2��![]() ��
��![]() ��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ
��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ![]() ��ʵ����
��ʵ����![]() �ķ�ѹ
�ķ�ѹ![]() �뷴Ӧʱ��
�뷴Ӧʱ��![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��
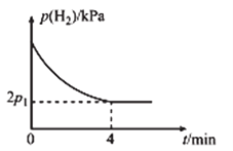
��![]() ʱ��
ʱ��![]() �ڣ�ƽ����Ӧ����
�ڣ�ƽ����Ӧ����![]() ______
______![]() (�ú�
(�ú�![]() �Ĵ���ʽ��ʾ����ͬ)��
�Ĵ���ʽ��ʾ����ͬ)��
��![]() ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��
ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��![]() _____
_____![]() (
(![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
��![]() ʱ��
ʱ��![]() �ڣ�
�ڣ�![]() �ļ�С��______(����������������������)
�ļ�С��______(����������������������) ![]() ��
��![]() �ļ�С��������Ϊ__________��
�ļ�С��������Ϊ__________��
����Ŀ��ijС��ͬѧ̽�����ʵ��ܽ�ȴ�С�����ת������֮��Ĺ�ϵ��
���������ϣ�
���� | BaSO4 | BaCO3 | AgI | AgCl |
�ܽ��/g��20�棩 | 2.4��10��4 | 1.4��10��3 | 3.0��10��7 | 1.5��10��4 |
��ʵ��̽����
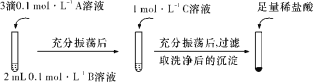
��һ��̽��BaCO3��BaSO4֮���ת����ʵ�����������ʾ��
�Լ�A | �Լ�B | �Լ�C | �������������� | |
ʵ��� | ||||
ʵ��� | BaCl2 | |||
Na2CO3 | Na2SO4 | ���� | ||
Na2SO4 | ���������ݲ��������������ܽ� |
��1��ʵ���˵��BaCO3ȫ��ת��ΪBaSO4�����ݵ������Ǽ���ϡ�����__________��
��2��ʵ����м���ϡ���������Ӧ�����ӷ���ʽ��_________��
��3��ʵ���˵�����������˲���ת�������BaSO4�ij����ܽ�ƽ�����ԭ��___________��
������̽��AgCl��AgI֮���ת����
��4��ʵ���֤��AgClת��ΪAgI��
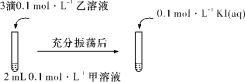
����Һ������______������ĸ���ţ���
a AgNO3��Һ����b NaCl��Һ����c KI��Һ
��5��ʵ��������Թ��н�����Һ�䷴Ӧʱ��ͬѧ�����۲쵽AgIת��ΪAgCl�����������������ʵ�飨��ѹ��������a��c��b��0����
װ�� | ���� | ��ѹ������ |
| ||
��.��ͼ����װ�ò������Լ����պ�K | a | |
��.��B�е���AgNO3��aq������������ȫ | b | |
��.����B��Ͷ��һ����NaCl��s�� | c | |
��.�ظ���������B�м����뢣������NaCl��s�� | a |
ע��������������ʱ������ԭ��ط�Ӧ������������ԭ�����������ԣ���ԭ�ԣ�Խǿ��ԭ��صĵ�ѹԽ�����ӵ������ԣ���ԭ�ԣ�ǿ������Ũ���йء�
�ٲ����й����Ͽ�֪��Ag��������I������AgNO3��Һ��KI��Һ������ǵõ�AgI������ԭ����������ԭ��Ӧ����__________������ڡ���С�ڡ���������Ӧ���ʡ���ƣ�����ʯī��s��[I����aq��//Ag����aq��]ʯī��s��������ԭ��أ�ʹ���������Ag����I������Ӵ�������ͼ��ʾ�����ԭ����ܷ�Ӧ�����ӷ���ʽΪ________��
�ڽ����Ϣ������ʵ�����b��a��ԭ��__________��
��ʵ�����������˵��AgIת��Ϊ
��ʵ����ۣ��ܽ��С�ij�������ת��Ϊ�ܽ�ȸ�С�ij�������֮���ף��ܽ�Ȳ��Խ�����ܽ��С�ij���ת���ܽ�Ƚϴ�ij���Խ��ʵ�֡�