题目内容
[化学--选修有机化学基础]
某化合物A在一定条件下能发生如下图所示的转变:

其中只有B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2,回答下列问题:
(1)指出反应类型:X
(2)物质A的结构简式为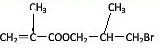
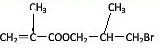 .
.
(3)写出C1C2的化学方程式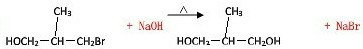
 .
.
(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有
 .(写一种)
.(写一种)
(5)与C2具有相同官能团的同分异构体(不包括C2,同个碳原子上不能有多个羟基)共有
某化合物A在一定条件下能发生如下图所示的转变:

其中只有B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2,回答下列问题:
(1)指出反应类型:X
取代
取代
反应,Y消去
消去
反应.(2)物质A的结构简式为
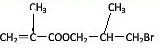
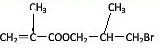
(3)写出C1C2的化学方程式


(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有


(5)与C2具有相同官能团的同分异构体(不包括C2,同个碳原子上不能有多个羟基)共有
5
5
种.分析:只有酯类在酸性或是碱性环境下水解可以得到醇类或是所酸类(或是羧酸盐),其中水解产物B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2,说明其中含有碳碳双键以及羧基,所以C1是含有羟基和溴原子的有机物质,在碱性环境下,溴原子水解生成醇羟基,根据C2可以氧化为羧酸类,可以知道C2属于醇类,据F的结构简式可以知道C2的结构简式为:OHCH2CH(CH3)CH2OH,则C1的结构简式为:OHCH2CH(CH3)CH2Br,所以B1的结构简式为: ,A是B1和C1发生酯化反应形成的酯,则A的结构简式为:
,A是B1和C1发生酯化反应形成的酯,则A的结构简式为: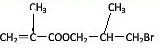 .
.
(1)根据化学反应发生条件来确定有机反应类型;
(2)酯可以在酸性或是碱性环境下水解得到羧酸和醇,根据A水解的产物B1和B2来确定有机物A的结构简式;
(3)卤代烃在强碱的水溶液中可以水解生成醇类物质;
(4)核磁共振氢谱只有一种峰的有机物说明只有一种等效氢原子,据此来书写同分异构体;
(5)根据同分异构体的官能团为异构以及类别异构知识来书写.
 ,A是B1和C1发生酯化反应形成的酯,则A的结构简式为:
,A是B1和C1发生酯化反应形成的酯,则A的结构简式为: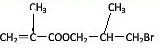 .
.(1)根据化学反应发生条件来确定有机反应类型;
(2)酯可以在酸性或是碱性环境下水解得到羧酸和醇,根据A水解的产物B1和B2来确定有机物A的结构简式;
(3)卤代烃在强碱的水溶液中可以水解生成醇类物质;
(4)核磁共振氢谱只有一种峰的有机物说明只有一种等效氢原子,据此来书写同分异构体;
(5)根据同分异构体的官能团为异构以及类别异构知识来书写.
解答:解:只有酯类在酸性或是碱性环境下水解可以得到醇类或是所酸类(或是羧酸盐),其中水解产物B1既能使溴水褪色,又能与Na2CO3 溶液反应放出CO2,说明其中含有碳碳双键以及羧基,所以C1是含有羟基和溴原子的有机物质,在碱性环境下,溴原子水解生成醇羟基,根据C2可以氧化为羧酸类,可以知道C2属于醇类,据F的结构简式可以知道C2的结构简式为:OHCH2CH(CH3)CH2OH,则C1的结构简式为:OHCH2CH(CH3)CH2Br,所以B1的结构简式为: ,A是B1和C1发生酯化反应形成的酯,则A的结构简式为:
,A是B1和C1发生酯化反应形成的酯,则A的结构简式为: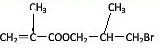 .
.
(1)A在酸性环境下会发生水解反应,故X属于水解反应或是取代反应,强碱的醇溶液加热是氯代烃发生消去反应的条件,故答案为:取代(或水解);消去;
(2)物质A的结构简式为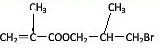 ,故答案为:
,故答案为: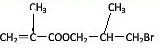 ;
;
(3)C1转化为C2的过程,是卤代烃水解的过程,其化学方程式为: ,故答案为:
,故答案为: ;
;
(4)与F互为同分异构体(分子中无环状结构),且核磁共振氢谱只有一种峰即只有一种类型的等效氢原子,这种有机物的结构简式为: ,故答案为:
,故答案为: ;
;
(5)C2的结构简式为:OHCH2CH(CH3)CH2OH,与C2具有相同官能团(含有两个醇羟基)的同分异构体有OHCH2CHOHCH2CH3、OHCH2CH2CH(OH)CH3、
OHCH2CH2CH2CH2OH、CH3CHOHCHOHCH3、OHCH2COH(CH3)CH3,共5种,故答案为:5.
 ,A是B1和C1发生酯化反应形成的酯,则A的结构简式为:
,A是B1和C1发生酯化反应形成的酯,则A的结构简式为: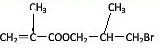 .
.(1)A在酸性环境下会发生水解反应,故X属于水解反应或是取代反应,强碱的醇溶液加热是氯代烃发生消去反应的条件,故答案为:取代(或水解);消去;
(2)物质A的结构简式为
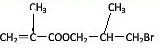 ,故答案为:
,故答案为: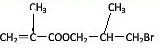 ;
;(3)C1转化为C2的过程,是卤代烃水解的过程,其化学方程式为:
 ,故答案为:
,故答案为: ;
;(4)与F互为同分异构体(分子中无环状结构),且核磁共振氢谱只有一种峰即只有一种类型的等效氢原子,这种有机物的结构简式为:
 ,故答案为:
,故答案为: ;
;(5)C2的结构简式为:OHCH2CH(CH3)CH2OH,与C2具有相同官能团(含有两个醇羟基)的同分异构体有OHCH2CHOHCH2CH3、OHCH2CH2CH(OH)CH3、
OHCH2CH2CH2CH2OH、CH3CHOHCHOHCH3、OHCH2COH(CH3)CH3,共5种,故答案为:5.
点评:本题考查学生有机物的化学性质以及推断方面的知识,注意知识的积累是解题的关键,难度大,综合性强.

练习册系列答案
相关题目



 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]