题目内容
[化学--选修3:物质结构与性质]X、Y、Z、W是元素周期表中前四周期中的四种元素,其中X的原子中不存在中子,Y原于的最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.请回答下列问题: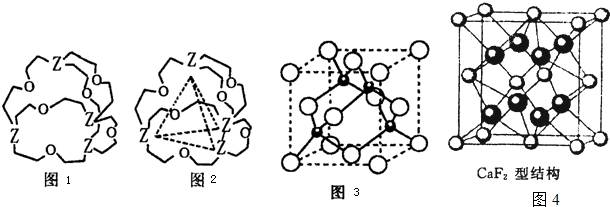
(1)写出Y原子基态时的价电子排布式: .
(2)X和Y可以形成Y2X4分子,1个Y2X4分子中含有σ键的数目为 ,其中Y原子的杂化轨道类型为 .
(3)元素Y的一种氧化物与元素2的一种氧化物互为等电子体,则元素Z的这种氧化物的分子式是 .
(4)图1表示某种含Z有机化合物的结构,其分子内4个Z原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物识别的是 (填标号).
A.CF4 B.CH4 C.NH
D.H2O
(5)元素W的一种氯化物晶体的晶胞结构如图3所示,该氯化物的化学式是 .已知其晶胞边长为a nm,则其晶体密度为 g?cm-3(列出算式即可).该氯化物可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,则反应的化学方程式为 .
(6)元素金(Au)与W形成的一种合金晶体具有立方最密堆积的结构,在晶胞中W原子处于面心,Au原子处于顶点位置.该晶体中原子之间的作用力是 ;该晶体具有储氢功能,氢原子可进入到由W原子与Au原子构成的四面体空隙中.若将W原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构图4相似,该晶体储氢后的化学式应为 .

(1)写出Y原子基态时的价电子排布式:
(2)X和Y可以形成Y2X4分子,1个Y2X4分子中含有σ键的数目为
(3)元素Y的一种氧化物与元素2的一种氧化物互为等电子体,则元素Z的这种氧化物的分子式是
(4)图1表示某种含Z有机化合物的结构,其分子内4个Z原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.下列分子或离子中,能被该有机化合物识别的是
A.CF4 B.CH4 C.NH
+ 4 |
(5)元素W的一种氯化物晶体的晶胞结构如图3所示,该氯化物的化学式是
(6)元素金(Au)与W形成的一种合金晶体具有立方最密堆积的结构,在晶胞中W原子处于面心,Au原子处于顶点位置.该晶体中原子之间的作用力是
分析:X、Y、Z、W是元素周期表中前四周期中的四种元素,其中X的原子中不存在中子,则X为H元素;Y原于的最外层电子数是其内层电子数的2倍,最外层电子数不能超过8个,内层为K层,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素,结合元素、物质的结构和性质分析解答.
解答:解:X、Y、Z、W是元素周期表中前四周期中的四种元素,其中X的原子中不存在中子,则X为H元素;Y原于的最外层电子数是其内层电子数的2倍,最外层电子数不能超过8个,内层为K层,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;W的原子序数为29,则W是Cu元素,
(1)Y是C元素,其最外层电子就是其价电子,2s能级上有2个电子,2p能级上有2个电子,所以其价电子排布式为2s22p2,故答案为:2s22p2;
(2)X和Y可以形成Y2X4分子是乙烯分子,乙烯的结构简式为CH2=CH2,一个乙烯分子中含有5个σ键,每个碳原子含有3个σ键且不含孤电子对,所以C原子的杂化轨道类型为sp2,
故答案为:5;sp2;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,则这两种化合物分别是CO2、N2O,则元素Z的这种氧化物的分子式是 N2O,故答案为:N2O;
(4)形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力,符合这样的选项就是C和D,但题中要求形成4个氢键,氢键具有饱和性,故选C;
(5)白色小球个数=8×
+6×
=4,黑色小球个数=4,所以其化学式为CuCl;
晶胞体积V=(a×10-7)3cm3,ρ=
=
g?cm-3=
g?cm-3,
CuCl和浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,根据化合物中化合价的代数和为0知,n=2,
所以该反应方程式为CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3],
故答案为:CuCl;
;CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3];
(6)合金中原子之间存在金属键,Cu原子处于面心,Au原子处于顶点位置,该晶胞中Cu原子个数=6×
=3,Au原子个数=8×
=1,根据图知,黑色小球相当于H原子,为8个,所以晶体储氢后的化学式应为H8AuCu3,
故答案为:金属键;H8AuCu3.
(1)Y是C元素,其最外层电子就是其价电子,2s能级上有2个电子,2p能级上有2个电子,所以其价电子排布式为2s22p2,故答案为:2s22p2;
(2)X和Y可以形成Y2X4分子是乙烯分子,乙烯的结构简式为CH2=CH2,一个乙烯分子中含有5个σ键,每个碳原子含有3个σ键且不含孤电子对,所以C原子的杂化轨道类型为sp2,
故答案为:5;sp2;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,则这两种化合物分别是CO2、N2O,则元素Z的这种氧化物的分子式是 N2O,故答案为:N2O;
(4)形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力,符合这样的选项就是C和D,但题中要求形成4个氢键,氢键具有饱和性,故选C;
(5)白色小球个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
晶胞体积V=(a×10-7)3cm3,ρ=
| m |
| V |
| ||
| (a×10-7)3 |
| 4×99.5 |
| (a×10-7)3NA |
CuCl和浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,根据化合物中化合价的代数和为0知,n=2,
所以该反应方程式为CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3],
故答案为:CuCl;
| 4×99.5 |
| (a×10-7)3NA |
(6)合金中原子之间存在金属键,Cu原子处于面心,Au原子处于顶点位置,该晶胞中Cu原子个数=6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:金属键;H8AuCu3.
点评:本题考查了晶胞的计算、化学式的确定、等电子体等知识点,这些都是学习重点和难点,会利用均摊法确定化学式,会根据密度公式计算晶胞,难度中等.

练习册系列答案
相关题目
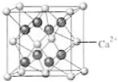 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是