题目内容
 [化学选修3:物质结构与性质]
[化学选修3:物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为
平面三角形
平面三角形
,其中心原子采取sp2
sp2
杂化;化合物N在固态时的晶体类型为分子晶体
分子晶体
.(2)R、X、Y三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
;(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为
N2O
N2O
(写分子式)(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质.该反应的离子方程式为
2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O
2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O
.(5)Z原子基态时的外围电子排布式为
3d24s2
3d24s2
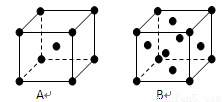
;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为6
6
.分析:根据前四周期元素,原子序数依次递增,Q为元素周期表中原子半径最小的元素则Q为氢元素;R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同则R的电子排布为1S22S22P2,即R为碳元素;Y的基态原子的核外成对电子数是未成对电子数的3倍,则Y的电子排布为1S22S22P4,即Y为氧元素;R、X、Y的原子序数依次递增,即X为N元素,然后推出则M为甲醛,N为苯,再由Z4+离子和氩原子的核外电子排布相同,则Z的原子序数为22,即Z为钛元素;
(1)根据孤电子对数和σ键数来分析杂化,利用构成晶体的微粒来分析晶体类型;
(2)根据元素的非金属性及电子的排布来分析元素的第一电离能;
(3)根据等电子体中的原子数和价电子数来分析;
(4)根据反应物和生成物来分析离子反应方程式;
(5)利用原子序数来分析电子排布,再利用晶体的结构来分析晶体内与每个Z原子等距离且最近的氧原子的位置.
(1)根据孤电子对数和σ键数来分析杂化,利用构成晶体的微粒来分析晶体类型;
(2)根据元素的非金属性及电子的排布来分析元素的第一电离能;
(3)根据等电子体中的原子数和价电子数来分析;
(4)根据反应物和生成物来分析离子反应方程式;
(5)利用原子序数来分析电子排布,再利用晶体的结构来分析晶体内与每个Z原子等距离且最近的氧原子的位置.
解答:解:由信息可知,Q为氢元素,R为碳元素,X为N元素,Y为氧元素,Z为钛元素,M为甲醛,N为苯;
(1)化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化,空间结构为平面三角形,化合物N为苯,是由碳、氢元素组成的化合物,苯是由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,故答案为:平面三角形;sp2;分子晶体;
(2)R、X、Y三种元素的分别为C、N、O,非金属性越强则元素的第一电离能越大,但N原子的电子排布中P轨道半满,则失去1个电子更难,即三种元素中N元素的第一电离能最大,
故答案为:C<O<N;
(3)RY2为CO2,分子中有3个原子,价电子数为4+6×2=16,N2O的分子中有3个原子,价电子数为5×2+6=16,则CO2与N2O互为等电子体,故答案为:N2O;
(4)由RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,由反应物与生成物,利用元素守恒、电荷守恒,则离子方程式为2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O;
(5)因Z4+离子和氩原子的核外电子排布相同,则Z的原子序数为22,即Z为钛元素,其电子基态电子排布为1S22S22P63S23P63d24s2,电子最后填充3d电子,则外围电子排布为
3d24s2,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,则氧原子数为
=6,故答案为:3d24s2;6.
(1)化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化,空间结构为平面三角形,化合物N为苯,是由碳、氢元素组成的化合物,苯是由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,故答案为:平面三角形;sp2;分子晶体;
(2)R、X、Y三种元素的分别为C、N、O,非金属性越强则元素的第一电离能越大,但N原子的电子排布中P轨道半满,则失去1个电子更难,即三种元素中N元素的第一电离能最大,
故答案为:C<O<N;
(3)RY2为CO2,分子中有3个原子,价电子数为4+6×2=16,N2O的分子中有3个原子,价电子数为5×2+6=16,则CO2与N2O互为等电子体,故答案为:N2O;
(4)由RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质,由反应物与生成物,利用元素守恒、电荷守恒,则离子方程式为2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O;
(5)因Z4+离子和氩原子的核外电子排布相同,则Z的原子序数为22,即Z为钛元素,其电子基态电子排布为1S22S22P63S23P63d24s2,电子最后填充3d电子,则外围电子排布为
3d24s2,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,则氧原子数为
| 1×3×8 |
| 4 |
点评:本题考查原子结构与性质,明确元素的位置、结构、性质是解答的关键,电子排布式、杂化类型、晶体类型、性质的比较是高考中常考的考点,N原子的第一电离能比O原子的大是学生解答的难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目