题目内容
(2013?兰州一模)[化学--选修3 物质结构与性质]
Ni、Fe是重要的金属,它们的单质及化合物在科学研究和工业生产中具有许多用途.
(1)基态Ni原子电子排布式为
(2)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
CO与N2结构相似,CO分子内σ键与π键个数之比为
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
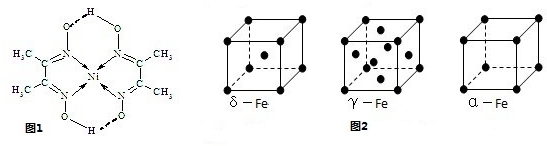
(5)铁有δ、γ、α三种同素异形体(图2),γ、α两种晶胞中铁原子的配位数之比为
cm(设NA为阿伏伽德罗常数,用含ρ和NA的代数式表示).
Ni、Fe是重要的金属,它们的单质及化合物在科学研究和工业生产中具有许多用途.
(1)基态Ni原子电子排布式为
1s22s22p63s23p63d84s2
1s22s22p63s23p63d84s2
;(2)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
C
C
.Ni的一种配合物的分子结构如图1所示,该配合物中C原子的杂化轨道类型是sp3、sp2
sp3、sp2
,配合物分子内不含有AC
AC
(填序号).A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
分子
分子
晶体.配合物Ni(CO)4中CO与N2结构相似,CO分子内σ键与π键个数之比为
1:2
1:2
;(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
>
>
FeO(填“<”或“>”);(5)铁有δ、γ、α三种同素异形体(图2),γ、α两种晶胞中铁原子的配位数之比为
2:1
2:1
.若δ晶体的密度为ρg?cm-3,该晶胞棱长为| 3 |
| ||
| 3 |
| ||

分析:(1)Ni元素是28号元素,核外电子数为28,根据核外电子排布规律书写;
(2)根据Ni的核外电子排布确定未成对电子数,再根据同周期自左而右电负性增大判断元素;
由图1可知,结构中含有两种C原子,位于甲基上、C=N中C原子,根据结构确定σ键,进而确定杂化轨道数目,确定杂化方式;
N原子与Ni原子之间形成配位键,N元素连接的氧原子与氧元素连接H原子之间形成氢键,N-O、O-H、C-H、C=N键属于极性键,C-C键属于非极性键;
(3)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;
CO与N2结构相似,故CO为的结构式为C≡O,三键含有1个σ键、2个π键;
(4)离子所带电荷相同,离子半径越小,离子键越强,晶体的熔点越高;
(5)由晶胞结构可知,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞确定配位数;
利用均摊法计算γ晶体晶胞中所含有的铁原子数N,令棱长为acm,则N×
=ρa3,据此计算.
(2)根据Ni的核外电子排布确定未成对电子数,再根据同周期自左而右电负性增大判断元素;
由图1可知,结构中含有两种C原子,位于甲基上、C=N中C原子,根据结构确定σ键,进而确定杂化轨道数目,确定杂化方式;
N原子与Ni原子之间形成配位键,N元素连接的氧原子与氧元素连接H原子之间形成氢键,N-O、O-H、C-H、C=N键属于极性键,C-C键属于非极性键;
(3)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于分子晶体;
CO与N2结构相似,故CO为的结构式为C≡O,三键含有1个σ键、2个π键;
(4)离子所带电荷相同,离子半径越小,离子键越强,晶体的熔点越高;
(5)由晶胞结构可知,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞确定配位数;
利用均摊法计算γ晶体晶胞中所含有的铁原子数N,令棱长为acm,则N×
| 56 |
| NA |
解答:解:(1)Ni元素是28号元素,核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)Ni的核外电子未成对电子数为2,第二周期中未成对电子数为2的元素有碳元素、氧元素,同周期自左而右电负性增大,故第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C;
由图1可知,结构中含有两种C原子,位于甲基上、C=N中C原子,甲基中C原子成3个C-H、1个C-C,故杂化轨道数目为4,采取sp3杂化,C=N中C原子成2个C-C、1个C=N,杂化轨道数目为3,采取sp2杂化,
N原子与Ni原子之间形成配位键,N元素连接的氧原子与氧元素连接H原子之间形成氢键,N-O、O-H、C-H、C=N键属于极性键,C-C键属于非极性键,故结构中不含离子键、金属键,
故答案为:C;sp3、sp2;AC;
(3)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体;
CO与N2结构相似,故CO为的结构式为C≡O,三键含有1个σ键、2个π键,CO分子内σ键与π键个数之比为1:2,
故答案为:分子;1:2;
(4)Ni2+和Fe2+的离子所带电荷相同,Ni2+离子半径较小,NiO中离子键更强,NiO晶体的熔点更高,
故答案为:>;
(5)由晶胞结构可知,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12.α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,故γ、α两种晶胞中铁原子的配位数之比为12:6=2:1,
γ晶体晶胞中所含有的铁原子数为1+8×
=2,令棱长为acm,则2×
=ρg?cm-3×(acm)3,解得a=
,
故答案为:2:1;
.
故答案为:1s22s22p63s23p63d84s2;
(2)Ni的核外电子未成对电子数为2,第二周期中未成对电子数为2的元素有碳元素、氧元素,同周期自左而右电负性增大,故第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C;
由图1可知,结构中含有两种C原子,位于甲基上、C=N中C原子,甲基中C原子成3个C-H、1个C-C,故杂化轨道数目为4,采取sp3杂化,C=N中C原子成2个C-C、1个C=N,杂化轨道数目为3,采取sp2杂化,
N原子与Ni原子之间形成配位键,N元素连接的氧原子与氧元素连接H原子之间形成氢键,N-O、O-H、C-H、C=N键属于极性键,C-C键属于非极性键,故结构中不含离子键、金属键,
故答案为:C;sp3、sp2;AC;
(3)Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体;
CO与N2结构相似,故CO为的结构式为C≡O,三键含有1个σ键、2个π键,CO分子内σ键与π键个数之比为1:2,
故答案为:分子;1:2;
(4)Ni2+和Fe2+的离子所带电荷相同,Ni2+离子半径较小,NiO中离子键更强,NiO晶体的熔点更高,
故答案为:>;
(5)由晶胞结构可知,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12.α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,故γ、α两种晶胞中铁原子的配位数之比为12:6=2:1,
γ晶体晶胞中所含有的铁原子数为1+8×
| 1 |
| 8 |
| 56g |
| NAmol-1 |
| 3 |
| ||
故答案为:2:1;
| 3 |
| ||
点评:本题考查核外电子排布规律、化学键、杂化轨道、晶体结构与性质、晶胞计算等,难度中等,(5)为易错点,需要学生具有较好的空间想象,注意利用均摊法计算晶胞.

练习册系列答案
相关题目
 (2013?兰州一模)神舟九号与“天宫一号”成功对接,是我国载人航天事业发展走向成熟的一个标志.空间实验室“天宫一号”的供电系统为再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.图为RFC工作原理示意图,下列有关说法正确的是( )
(2013?兰州一模)神舟九号与“天宫一号”成功对接,是我国载人航天事业发展走向成熟的一个标志.空间实验室“天宫一号”的供电系统为再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.图为RFC工作原理示意图,下列有关说法正确的是( )